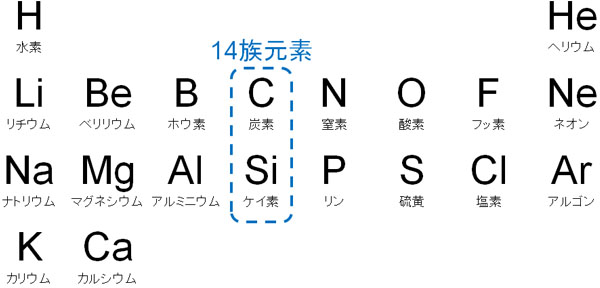
無機化学で学ぶ14族元素は炭素Cとケイ素Siがメインになります。14族元素には炭素C、ケイ素Si、ゲルマニウムGe、スズSn、鉛Pbがあります。この中で非金属元素は炭素とケイ素であり、無機化学で15族元素を学ぶとき、炭素とケイ素がメインになるのです。
炭素を含む分子で重要なのは一酸化炭素と二酸化炭素です。両方とも、私たちにとって身近な化合物です。
またケイ素については、二酸化ケイ素やケイ酸ナトリウムの性質を学びましょう。岩石の主成分が二酸化ケイ素であり、ケイ素についても私たちにとって身近です。
炭素とケイ素は私たちにとって非常に身近であるため、無機化学でも重要な元素です。そこで、炭素とケイ素の性質を解説していきます。
もくじ
炭素の同素体:黒鉛、ダイヤモンド、フラーレン
まず、14族元素は元素周期表のどこに該当するのでしょうか。以下が14族元素になります。
炭素を含む化合物を有機物といいます。そのため、私たちの体には多くの炭素が存在します。またフラーレンやカーボンナノチューブなど、丈夫な素材は炭素で構成されています。宝石で知られるダイヤモンドも炭素が構成成分です。
単体での炭素の特徴は同素体をもつことです。炭素の同素体としては黒鉛、ダイヤモンド、フラーレンが有名です。

黒鉛は平面構造であり、薄い層がいくつも積み重なっています。そのためはがれやすく、黒色の線を描くことができます。
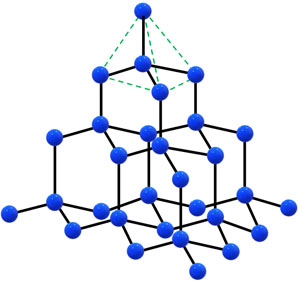
一方でダイヤモンドは正四面体構造であり、炭素が規則正しく並んでいます。そのためダイヤモンドには透過性があります。また共有結合によって炭素が強力につながっているため、非常に硬いです。
また、フラーレンは炭素Cが60個つながることにより、サッカーボールのような形をしています。単体の炭素原子を学ぶとき、最も重要な内容が同素体です。
一酸化炭素(CO)は無色・無臭の有毒なガス
それでは、炭素を含む化合物として何があるのでしょうか。すべての有機物は炭素を含みます。それに対して、無機化学で重要な「炭素を含む分子」に一酸化炭素(CO)があります。
一酸化炭素は無色・無臭の有毒なガスです。不完全燃焼によって一酸化炭素が発生し、毎年多くの人が一酸化炭素中毒によって死亡しています。
一酸化炭素が有毒な理由は、赤血球と強く結びつく働きがあるからです。赤血球に一酸化炭素が結合すると、赤血球は酸素を運ぶことができません。また、一酸化炭素と赤血球が結合したら外れません。こうして、全身が酸素欠乏に陥るのです。
一酸化炭素は中性の気体であり、水に溶けにくいです。なお、一酸化炭素を実験室で発生させる場合、ギ酸(HCOOH)に触媒として濃硫酸を加え、加熱します。そうすると、濃硫酸による脱水作用によってH2Oがギ酸の分子内から取り除かれ、一酸化炭素(CO)を得られます。
- HCOOH → H2O + CO
前述の通り一酸化炭素は水に溶けにくいため、発生させた気体は水上置換によって集めます。
なお一酸化炭素は空気中で速やかに酸化され、二酸化炭素になります。これはつまり、一酸化炭素は還元剤であることを意味します。相手から酸素を奪う働きがあるため、一酸化炭素は還元剤として利用されることもあります。
例えば一酸化炭素は高温で酸化鉄を還元します。
- Fe2O3 + 3CO → 2Fe + 3CO2
この方法により、酸化鉄から単体の鉄を得ることができます。
二酸化炭素(CO2)の性質:炭酸やドライアイス、石灰水
一酸化炭素を学んだら、次に二酸化炭素の性質を確認しましょう。無色・無臭の気体が二酸化炭素(CO2)であり、空気よりも重いです。
なお、二酸化炭素は日常生活でひんぱんに利用されています。例えば二酸化炭素は水に少し溶けることができ、水に溶解後は炭酸(H2CO3)で存在します。炭酸水やビールに含まれている炭酸の正体は二酸化炭素なのです。
- CO2 + H2O → H2CO3
なお、炭酸は弱酸性を示すことで知られています。
- H2CO3 ⇆ H+ + HCO3–
他には、二酸化炭素を冷やすことによって固体にするとドライアイスになります。ドライアイスは非常に冷たいため、保冷したいときに適しています。

ドライアイスは液体になることがなく、固体から気体へ昇華する性質があります。液体にならないため、冷却材での利用に適しています。
なお二酸化炭素の実験的製法としては、石灰石(炭酸カルシウム:CaCO3)へ塩酸HClを加えます。これにより、二酸化炭素を得ることができます。
- CaCO3 + 2HCl → CaCl2 + H2O + CO2
前述の通り、炭酸は弱酸です。そのため石灰石(炭酸カルシウム)は弱酸の塩です。そこで強酸である塩酸を加えることにより、強酸と強塩基に由来する塩(塩化カルシウム:CaCl2)が生成され、二酸化炭素と水が発生するのです。
・水酸化カルシウム水溶液:石灰水Ca(OH)2との反応
なお二酸化炭素は水酸化カルシウム水溶液(石灰水:Ca(OH)2)と反応することで白濁することが知られています。前述の通り、二酸化炭素は水に少し溶け、炭酸になります。そのため二酸化炭素を石灰水に通すと炭酸カルシウム(CaCO3)が生成されます。
- Ca(OH)2 + CO2 → CaCO3 + H2O
炭酸カルシウム(CaCO3)は白色の固体であるため、水溶液中に固体が析出することによって白濁します。
ただ白濁した水溶液に対して、さらに二酸化炭素を通すと透明になります。この理由は、炭酸水素カルシウムCa(HCO3)2が生成され、水に溶けるからです。
- CaCO3 + H2O + CO2 → Ca(HCO3)2
二酸化炭素は水溶液に溶けることで炭酸になり、一部が炭酸イオンになります。そのため、炭酸水素カルシウムを生成するのです。
単体のケイ素はダイヤモンドと似た結晶構造
私たちにとって、炭素ほどなじみはないものの、私たちの周囲にたくさん存在する元素にケイ素があります。
ケイ素の単体は自然界には存在しません。ただ二酸化ケイ素(SiO2)にコークス(C)を加えることによって、単体のケイ素Siを得ることができます。
- SiO2 + 2C → Si + 2CO
ダイヤモンドと同じように、Siは共有結合の結晶を作ります。炭素と同じ14族元素であり、4つの価電子をもつため、ダイヤモンドと同じ結晶構造となるのです。ただ、ダイヤモンドほどの硬さはありません。
二酸化ケイ素(SiO2)は石英や水晶の成分
それでは、ケイ素を含む分子を確認していきましょう。無機化学では、二酸化ケイ素がケイ素Siを含む化合物として有名です。
岩石の主成分が二酸化ケイ素です。岩石は複数の物質の混合物であるものの、純水な二酸化ケイ素は石英や水晶と呼ばれています。つまり、透明性の高い結晶が二酸化ケイ素です。また、ガラスも二酸化ケイ素(SiO2)が主成分です。

二酸化ケイ素は安定な物質です。ただフッ化水素(HF)には溶けます。
無機化学でハロゲンを学ぶとき、フッ化水素はガラス(二酸化ケイ素)を溶かすことを習います。このとき、二酸化ケイ素とフッ化水素酸(フッ化水素の水溶液)が触れることにより、以下の化学反応が起こります。
- SiO2 + 6HF → H2SiF6 + 2H2O
この反応によって生成するH2SiF6をヘキサフルオロケイ酸といいます。
・強塩基と反応し、ケイ酸塩を生成する
また、二酸化ケイ素は強塩基と反応してケイ酸塩を生成します。例えば水酸化ナトリウムと反応することによってケイ酸ナトリウムが生成されます。
- SiO2 + 2NaOH → Na2SiO3 + H2O
ケイ酸ナトリウム(Na2SiO3):水ガラスとシリカゲル(乾燥剤)
それでは、ケイ酸ナトリウム(Na2SiO3)の性質を確認していきましょう。ケイ酸ナトリウムと水を混ぜると、粘性の高い無色透明の液体になります。これを水ガラスといいます。
またケイ酸ナトリウムに塩酸(HCl)を加えると、白色のゲル状固体を得ることができます。これをケイ酸(H2SiO3)といいます。
- Na2SiO3 + 2HCl → 2NaCl + H2SiO3
ケイ酸を得られる理由は弱酸の遊離です。強酸である塩酸を加えることによって、強塩基由来のNa+と強酸由来のCl–がイオン結合します。また弱酸由来のSiO32-が遊離し、結果としてケイ酸が生成されます。
なおケイ酸を乾燥させ、脱水するとシリカゲルと呼ばれる物質になります。シリカゲルは乾燥剤として多用されており、食品の中にシリカゲルが入っていることがひんぱんにあります。以下がシリカゲルです。

シリカゲルを利用すれば、食品が湿気てしまうのを防げます。
14族元素の性質を学ぶ
金属を含めると、14族元素には重要な元素がいくつもあります。ただ無機化学で14族元素を学ぶとき、一般的には非金属元素に着目しましょう。そこで、炭素Cとケイ素Siの性質を学びましょう。
炭素には同素体があります。また炭素を含む無機化合物として、一酸化炭素と二酸化炭素の性質を学びましょう。
一方、ケイ素も自然界に多く存在する元素です。特に二酸化ケイ素とケイ酸ナトリウムは私たちにとって身近な化合物であるため、特徴を理解しましょう。
最も身近な元素の一つが炭素とケイ素です。私たちの生活で欠かせない元素であるため、無機化学を学ぶときに炭素とケイ素の特徴を覚えるのは重要です。






