有機化学では環状化合物を取り扱うことがよくあります。代表的な環状化合物はシクロヘキサンであり、こうした化合物を利用して合成反応を行います。
ただ、環状化合物にはひずみがあります。立体障害などにより、エネルギーの高い状態になっているのです。ひずみがあるほど不安定な状態であり、化合物の反応性は高くなります。またひずみを理解すれば、化合物がどのような立体配座になっているのかを理解できるようになります。
こうした立体配座で特に重要なのがシクロヘキサンです。有機化学は平面ではなく、立体で考える必要があります。そうしたとき、シクロヘキサンでは立体化学で考えなければいけないことが非常にたくさんあります。
そこで環状化合物で問題になりやすい「ひずみ」について解説し、その後に安定性や立体配座について確認していきます。
もくじ
環状化合物にはひずみと立体障害がある
アルカンなどの化合物であれば、分子の軸が回転することで自由に形を作ることができます。しかし、環状化合物ではアルキル鎖のように自由に軸が動けるわけではありません。炭素鎖は固定されています。
化合物は理想とする形があります。ただ環状化合物のように動きが制限されている場合、分子内でひずみを生じるようになります。その結果、分子が保有するエネルギーが高くなります。
これらのひずみには、主に以下が知られています。
- 結合角ひずみ
- ねじれひずみ(二面角ひずみ)
- 立体ひずみ
シクロアルカンの炭素原子はsp3混成軌道です。この場合、結合角が109.5°だと理想的な角度であり、安定な構造です。例えば、メタンの結合角は109.5°です。
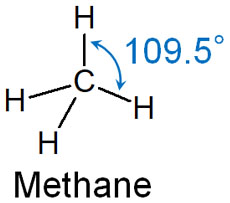
ただ環状化合物では、結合角が109.5°でないことがあります。その場合、結合角ひずみが起こります。
また立体化学では二面角ひずみも知られています。分子同士の結合するとき、二面角の角度(θ)は60°が理想です。
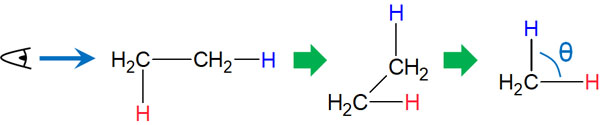
二面角が重なると、結合に関与している電子が反発します。また立体障害も引き起こします。その結果、エネルギーが高くなります。
なお、より大きな置換基が接近していると立体障害は大きくなります。シクロアルカンでは分子が環状になっているため、頻繁に立体障害を引き起こします。
シクロプロパンはひずみが大きい
環状化合物は具体的に、どのようなひずみを生じているのでしょうか。環状化合物としては、例えばシクロプロパンが知られています。炭素3つの化合物がプロパンであり、シクロプロパンでは環状化合物になっています。
シクロプロパンは三角形であるため、結合角は60°です。理想的な結合角である109.5°から大きくずれています。そのため、シクロプロパンは結合角ひずみ(angle strain)が非常に大きいです。
またニューマン投影式でシクロプロパンを書くと、C-H結合が重なっていることが分かります。二面角は60°ではなく、0°になっているのがシクロプロパンです。その結果、シクロプロパンはねじれひずみ(二面角ひずみ)を有するようになります。
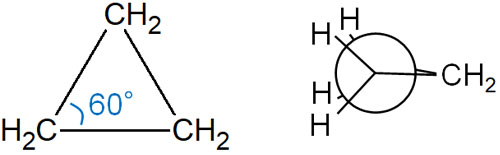
これらのひずみがあるため、シクロプロパンは非常にエネルギーが高いことで知られています。シクロプロパンは不安定な化合物であり、化学反応しやすくなっています。
シクロブタン、シクロペンタンはひずみが小さくなる
一方でシクロブタンやシクロペンタンではどうなのでしょうか。これらの化合物では、シクロプロパンに比べると結合角が大きくなり、109.5°に近づきます。
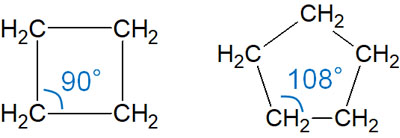
ただ、結合角が109.5°でないのは変わりありません。そのため、これらの化合物には結合角ひずみがあります。ただ、シクロプロパンよりはエネルギーが低く安定性が高いです。
また、これらの環状化合物はねじれひずみも有します。結合角や二面角が固定されるため、アルキル鎖に比べると環状化合物はエネルギーが高いです。
シクロヘキサンの安定性といす型配座
一方でシクロヘキサンはどうでしょうか。シクロヘキサンでは角度が120°であり、結合角ひずみを有するように思ってしまいます。ただシクロヘキサンでは、いす形配座という形をとっています。平面では結合角が120°であるものの、立体化学で考えるとシクロヘキサンの結合角は109.5°です。
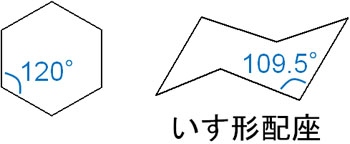
またシクロヘキサンのいす形配座では、二面角が60°になっています。そのため、ねじれひずみがありません。以下はシクロヘキサンのニューマン投影式の様子です。
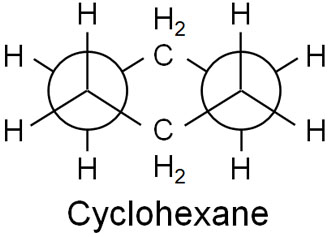
シクロヘキサンでは、結合角ひずみとねじれひずみの両方がありません。そのため、他の環状化合物に比べて安定です。
より正確にいうと、いす形配座であったとしても結合角は109.5°ではありません。ただすべての結合角が109.5°に近く、シクロヘキサンの結合角ひずみは非常に小さくなっています。
エクアトリアル・アキシアルと環反転の概念
そうしたとき、シクロヘキサンの立体化学で重要な概念としてエクアトリアルとアキシアルがあります。シクロヘキサンでは、12のC-H結合があります。以下の通りです。
いす形配座のC-H結合をみると、水素原子が横に出ているケースと垂直に出ているケースの2種類が存在すると分かります。シクロヘキサンでは、それぞれ以下のように呼ばれています。
- エクアトリアル:横向きの位置
- アキシアル:たて向きの位置
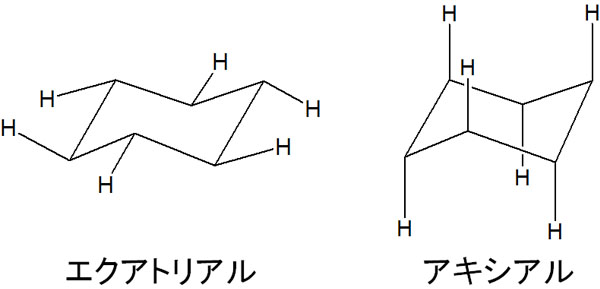
シクロヘキサンにある結合のうち、横向きの位置にあるのがエクアトリアルです。一方でアキシアルでは、上または下向きに水素原子が位置しています。いす形配座では、2種類の位置が存在することを理解しましょう。
・シクロヘキサンは環反転する
なお、シクロヘキサンのいす形配座は環反転します。そのため、あるときはエクアトリアルであることがあれば、他の条件下ではアキシアルになることもあります。
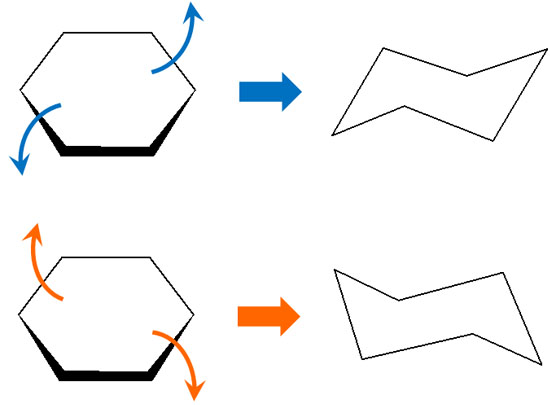
有機化学では立体化学で考える必要があるため、シクロヘキサンではこうした環反転があることを考慮しなければいけません。
1,3-ジアキシアル相互作用(反発)による立体障害
それでは、シクロヘキサンに置換基がある場合はどのように立体化学を考えればいいのでしょうか。例えば、メチルシクロヘキサンがあるとします。メチルシクロヘキサンを平面で記すと、一種類のみ書くことができます。
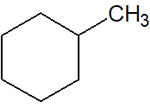
しかし立体化学で考えると、シクロヘキサンには2つの立体配座があることに気が付きます。メチル基がエクアトリアルになるのか、アキシアルにあるのかによって位置が異なります。
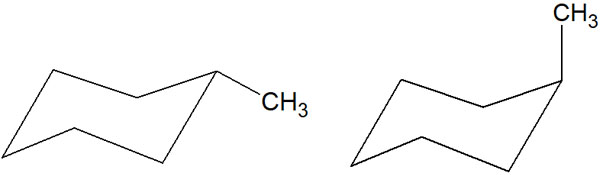
この点について、どのように考えればいいのでしょうか。シクロヘキサンがいす形配座になるにしても、メチル基はエクアトリアルとアキシアルのどちらの位置にあるのでしょうか。
答えとしては、シクロヘキサンのメチル基はエクアトリアルのほうが安定です。アキシアルの位置にあると、エネルギーが高く不安定になります。この理由としては、立体障害があります。
アキシアルの位置にメチル基があると、他のアキシアルにある水素原子と立体障害を起こすようになります。立体ひずみを起こすことで、不安定となるのです。以下では、メチル基によって反発を起こす様子を記しています。

このように、アキシアルの位置で立体ひずみを生じることを1,3-ジアキシアル相互作用といいます。1,3-ジアキシアル相互作用では、水素原子2つと反発しています。
一方でエクアトリアルではどうでしょうか。この場合、1,3-ジアキシアル相互作用による反発は起こりません。シクロヘキサンの横にメチル基が存在するため、他の水素原子に対して接近することはありません。以下のようになっています。
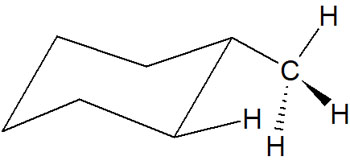
こうした1,3-ジアキシアル相互作用による立体障害があるため、シクロヘキサンに置換基がある場合、エクアトリアルの立体配座になることが多いです。
なお、今回はメチル基を例に立体障害を考えました。そうしたときメチル基ではなく、tert-ブチル基などより大きな置換基が結合している場合、1,3-ジアキシアル相互作用による立体ひずみはより大きくなります。その場合、置換基は、よりエクアトリアルの配座になろうとします。
シス・トランスの2置換シクロヘキサンでの安定性
ただ、世の中の環状化合物は1つの置換基だけを有するとは限りません。2つの置換基を有することがあります。この場合、どのように考えればいいのでしょうか。
2つの置換基がある場合、シスとトランスの2パターンが存在します。例えば、メチル基を2つ有する場合は以下の2つの構造式を書くことができます。
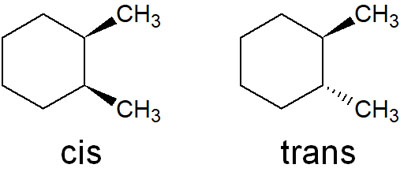
これらの立体異性体があるため、2置換シクロヘキサンではシスとトランスの両方を考慮しなければいけません。
そうしたとき、シスでは以下の2つの立体配座になります。
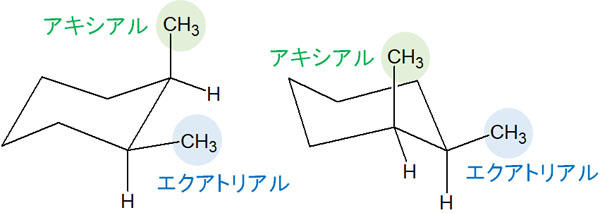
シスでは、一方のメチル基がエクアトリアルの位置にある場合、もう一方のメチル基はアキシアルに存在します。当然、アキシアルにあるメチル基は1,3-ジアキシアル相互作用を起こします。ただ、どちらのケースであってもアキシアルにメチル基が存在するため、それぞれの配座についてエネルギーに違いはありません。
それに対して、トランスではどうなるのでしょうか。トランスでは、2つのメチル基が両方ともエクアトリアルまたはアキシアルの位置にある立体配座となります。
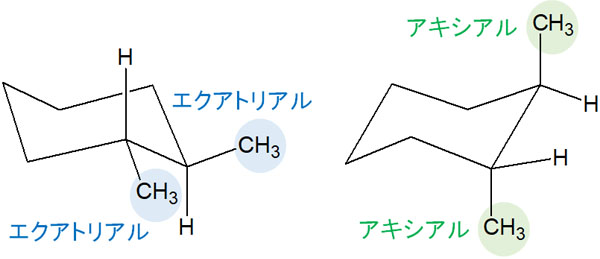
既に説明した通り、アキシアルの位置にメチル基があると1,3-ジアキシアル相互作用による立体反発が起こります。そのため立体異性体の中でも、トランスの2置換シクロヘキサンでは、エネルギーに違いを生じるためエクアトリアルの立体配座が優先されます。
舟形配座はひずみが大きい
ここまで、環状化合物のひずみやシクロヘキサンでのいす形配座の安定性について解説してきました。シクロヘキサンでは、いす形配座が最も安定です。
ただ、シクロヘキサンが取れる形はいす形配座だけではありません。そのほかの立体配座になることも可能です。シクロヘキサンが取れる立体配座にはいくつか種類があります。その中でも、重要な立体配座として舟形配座があります。
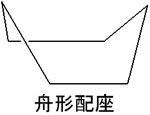
シクロヘキサンが環反転できることは既に述べました。環反転するとき、シクロヘキサンは中間体として舟形配座を取ります。
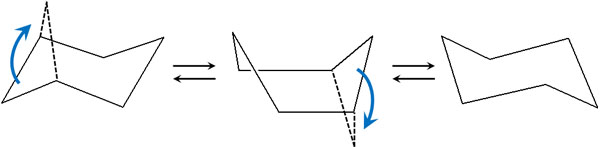
ただ、いす形配座に比べて、舟形配座はひずみが大きいです。まず舟形配座では、ねじれを起こします。60°ではなく、重なることで二面角は0°になります。その結果、舟形配座ではねじれひずみが起こります。
ニューマン投影式で舟形配座を書くと以下のようになります。

それに加えて、舟形配座では立体障害があります。水素原子が接近するため、立体反発によって立体ひずみを起こします。
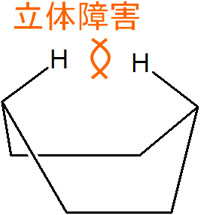
これらの理由から、舟形配座のポテンシャルエネルギーは高くなっています。
環反転のエネルギー図で考える立体障害
いす形配座から舟形配座になるためには、シクロヘキサンは立体配座を変える必要があります。環状化合物として立体が既に決まっている状態で形を変える必要があるため、環反転するためにはエネルギーが必要になります。
もちろん、いす形配座から船型になるためには大きなエネルギーが必要です。また船型配座から、再びいす形配座へ戻るときも大きなエネルギーが必要です。
シクロヘキサンが環反転するとき、いくつかの不安定な構造を経由する必要があります。これらの構造には、ねじれ舟形配座を含みます。エネルギー図で記すと以下のようになります。
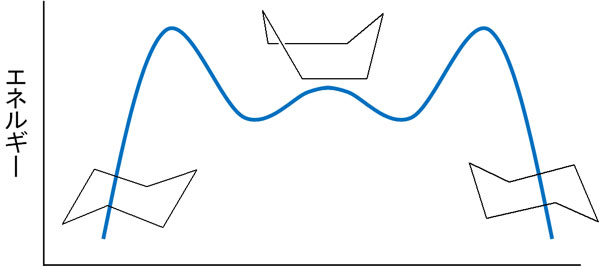
シクロヘキサンで環反転が起こるとはいっても、ねじれ舟形配座や舟形配座など、こうしたエネルギーを経由して立体配座を変える必要があります。中間体として舟形配座になり、その後に立体配座が変わります。
環状化合物の立体化学は安定性が重要
有機化学では、平面で化合物を書くことが多いです。ただ分子が化学反応するときは立体です。そのため、立体化学を考慮しなければいけない場面がたくさんあります。その中の一つが環状化合物です。環状化合物を立体で考えると、多くのひずみを生じることでエネルギーが高くなったり低くなったりします。
またシクロヘキサンでは、いす形配座であっても置換基がエクアトリアルとアキシアルのどこに存在するのかによって、エネルギー状態が違ってきます。シス・トランス異性体についても、置換基の場所によって立体配座が違います。
それに加えて、シクロヘキサンは環反転します。環反転のときは舟形配座となり、立体反発などのひずみによってエネルギー状態が高くなります。
このように、立体で考えるのが環状化合物の安定性です。立体配座は有機化学の反応性に関わるため、どのようなときに安定構造を取れるのか理解するようにしましょう。






