有機化学の合成反応で頻繁に利用される方法として、SN1反応とSN2反応があります。有機化学者では全員が確実に利用するほど、利便性の高い合成反応です。
SN1反応とSN2反応は求核置換反応と呼ばれる合成反応であり、置換基が入れ替わります。
ただ、どのような化合物を反応させるのかによって反応機構が異なります。また合成反応の進みやすさも違います。これらの反応機構を学ばなければ、思った通りの化合物を手にすることができません。合成反応で利用する溶媒も重要です。
そこで有機化学反応で基本ともいえるSN1反応とSN2反応について、どのような反応機構によって合成反応が進んでいくのかを分かりやすく解説していきます。
もくじ
電子密度の高い物質が求核剤(Nu)
求核置換反応を学ぶ前に、そもそも求核剤(Nu)とは何かを理解しなければいけません。求核剤では、どれも電子密度が高くなっています。その結果、他の化合物を攻撃することで新たな結合を作ろうとします。
それでは、どのような場合に電子密度が高くなり、求核剤として機能するのでしょうか。このとき以下の条件を満たす場合、求核剤になりやすいです。
- 非共有電子対(孤立電子対)がある
- 電気陰性度が高い
電気陰性度が高い原子では、多くの電子を引き寄せることで電子リッチの状態になりやすいです。さらに非共有電子対があることで、結合に関与していない孤立電子対が他の分子を攻撃しやすくなります。
- OH–
- NH3
これらは求核剤として機能することが広く知られています。なおアニオンなどのように、マイナスに荷電していると特に求核剤となりやすいです。
脱離基(L)が存在する求核置換反応
それでは、求核剤が存在すれば常に求核置換反応が起こるのでしょうか。当然、そういうわけではありません。求核置換反応では、求核剤が存在するだけでなく他にも条件があります。それは脱離基(L)の存在です。脱離基があるからこそ、求核置換反応が進行します。
「電子を受け取ることで、安定化しやすい分子(または原子)」が脱離基になりやすいです。代表的な脱離基にはハロゲンがあります。
- 塩素(Cl)
- 臭素(Br)
- ヨウ素(I)
これらが脱離基(L)になりやすいです。脱離基があることで、例えば以下のように反応が進みます。
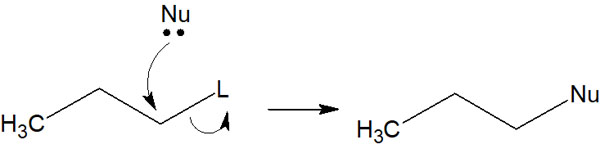
なお、NuやLなどの記号では理解しにくいです。実際の合成反応だと、以下のようになります。
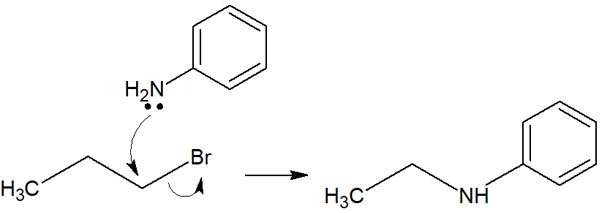
このように、脱離基と求核剤が置き換わります。そのため置換反応と呼ばれています。なおハロゲンは求核剤として機能することがあるものの、脱離基として頻繁に用いられます。
反応機構は異なるものの、SN1反応とSN2反応の両方とも脱離基が関与します。
二段階の反応になるのがSN1反応
それでは、実際に合成反応がどのようになっているのか確認していきましょう。
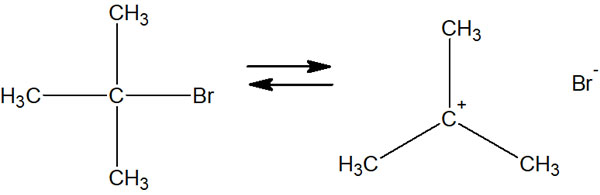
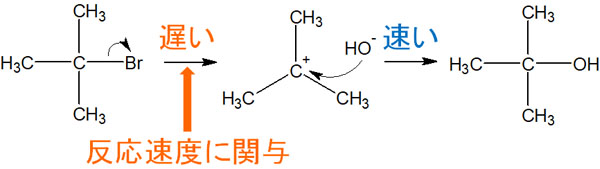
SN1反応では最初に脱離基が離れることが合成反応のスタートになります。その結果、カルボカチオンが生成されます。すべてのSN1反応では、脱離基が離れることから始まります。
共有結合で強く結合しているのに、勝手に結合が切れて脱離するのかについて疑問に思うかもしれません。ただ、脱離基は勝手に共有結合を切って離れようとします。
例えばハロゲンは電気陰性度が強いことで知られています。そのため、分子内でプラスとマイナスの電荷に分かれており、分極しています。電荷の偏りが大きいため、機会があればハロゲンは分子から離れようと考えています。そこで分子から脱離基が離れて、カルボカチオンが生成されます。
ただカルボカチオンは不安定な中間体なので、化合物は離れたハロゲンを再び捕まえることで分子の形を維持しようとします。
ただ、同じ溶液中に求核剤があればどうでしょうか。この場合、脱離基が分子を離れた瞬間に求核剤がカルボカチオンを攻撃します。
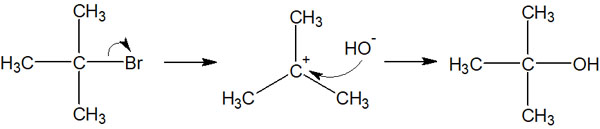
カルボカチオンが離れた脱離基(ハロゲンなど)を捕まえようとするよりも、求核剤がカルボカチオンを攻撃するスピードのほうが速いです。その結果、SN1反応が起こります。
- 脱離基が離れ、カルボカチオンを生じる
- 求核剤がカルボカチオンを攻撃する
このように2つの反応が関わっていることから、SN1反応は二段階反応といわれています。
カルボカチオンが安定だとSN1反応が起こる
SN1反応ではカルボカチオンの生成が必須条件です。そのため、どれだけカルボカチオンが生成しやすいのかが反応速度に大きく関与します。もっと正確にいうと、中間体のカルボカチオンが安定であるほど、反応速度が速いです。
カルボカチオンが不安定な中間体であるのは間違いないです。ただ中間体が生成されなければ、脱離基が離れることでSN1反応を生じることはありません。そのため、SN1反応が起こるかどうかの要素として、カルボカチオンの安定性が非常に重要です。
カルボカチオンは以下の順番で安定です。
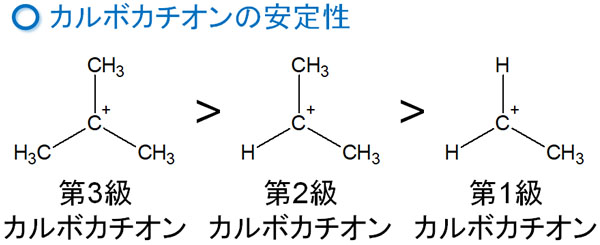
カルボカチオンに対して、結合しているアルキル鎖の数が多いほど中間体は安定になりやすいです。実際のところ、自然に第一級カルボカチオンを生じることはありません。ただ第三級カルボカチオンであれば、安定構造になりやすいのです。
SN1反応の反応速度は1つの分子に依存する
なぜ、SN1反応というのでしょうか。これは求核置換反応の中でも、反応速度(律速段階)に関わる分子が一つだけだからです。反応速度を決める部分が律速段階です。律速段階が一つしかないため、1という数字を使い、SN1反応と呼びます。
SN1反応では、どこか律速段階になるのでしょうか。SN1反応の反応速度を決めるのは、求核剤ではありません。そうではなく、カルボカチオンの生成する部分が律速段階になります。
カルボカチオンさえ生成すれば、すぐに求核剤がカルボカチオンを攻撃します。ただカルボカチオンが生まれなければ、SN1反応は起こりません。どれだけ求核性の高い試薬(電子密度の高い試薬)であったとしても、カルボカチオンが生成されるかどうかが重要なので、SN1反応の反応速度は変わりません。
あくまでもSN1反応で反応速度に関与するのは、脱離基が結合している化合物だけです。求核剤は反応速度に関与しません。
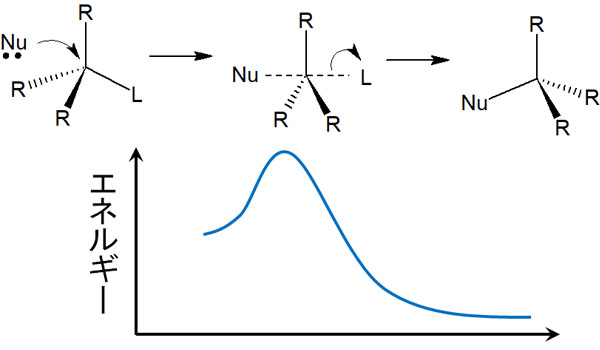
SN1反応の律速段階では、エネルギー図を使って説明されることがあります。エネルギー図にすると、以下のようになります。
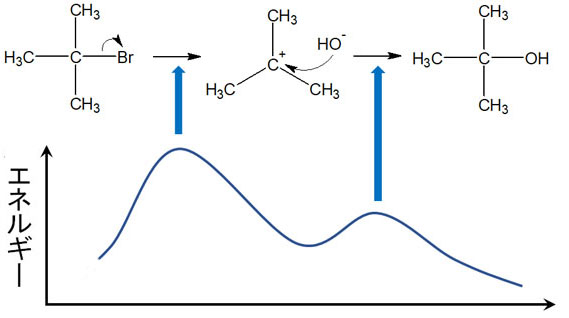
SN1反応では、カルボカチオンが生成される最初で最も高いエネルギーが必要になります。エネルギーの高い状態を遷移状態といいます。遷移状態になるためには、多くのエネルギーが要求されるのです。
一方で求核剤が攻撃する段階では、遷移状態のエネルギーは低いです。そのため最初の反応さえ進めば、後は自動的に化学反応が進行します。そのため、SN1反応では一段階目が律速段階となります。
ちなみにSN1反応の起こりやすさを記すと以下のようになります。
- 第三級>第二級>>>第一級>メチルカチオン
第一級カルボカチオンでは、SN1反応が起こらないと既に述べました。これは、単純に第一級カルボカチオンがほとんど生成されないからです。一方で第二級カルボカチオンでは速度が遅いものの、SN1反応が進行します。これが第三級カルボカチオンになると、より反応速度は速くなります。
なお第一級カルボカチオンであっても、アリルカチオンやベンジルカチオンでは例外的にSN1反応が進行します。
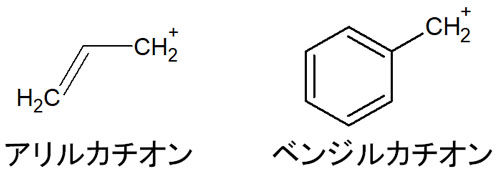
アリルカチオンやベンジルカチオンでは、隣に二重結合があります。そのため共鳴構造を書くことができ、カチオンの構造が安定します。その結果、SN1反応を生じます。
立体化学ではSN1反応でラセミ体となる
なお求核置換反応では立体化学を考えなければいけません。SN1反応の立体化学ではラセミ化します。つまり立体化学を考慮しなければいけない場合、ラセミ体による2つの物質が作られると理解しましょう。
カルボカチオンが生成したあと、求核剤は上からまたは下からの2方向から不斉炭素原子を攻撃することができます。その結果、ラセミ化します。
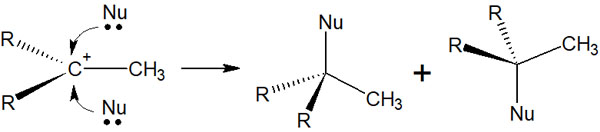
もちろんカルボカチオンに結合している置換基が同じの場合、不斉炭素原子ではないため、立体化学は関係ありません。そのためラセミ体は生じません。ただキラル炭素に結合している置換基がすべて異なる場合、鏡像異性体を生じるようになります。
立体化学で重要となるのがラセミ体です。SN1反応ではラセミ化により、生成物が混ざり合うことを理解しましょう。
反対側からの攻撃で立体反転するSN2反応:Walden反転
一方でSN2反応はどのようになっているのでしょうか。ラセミ体を作るSN1反応とは異なり、SN2反応では反対側から攻撃を受けることで立体反転します。
SN2反応ではカルボカチオンは生成しません。その代わり、以下のように求核剤が反対側から攻撃し、遷移状態の後に立体反転した化合物が生まれます。
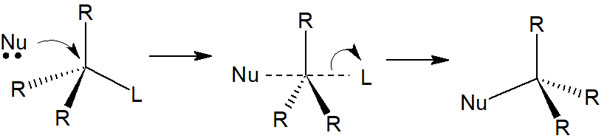
このように、脱離基と入れ替わるようにして求核剤が攻撃します。
SN1反応のようにカルボカチオンを生じる場合、上と下の2方向から求核剤は攻撃できます。一方でSN2反応では反対側からしか攻撃しないため、ラセミ化はしません。立体反転した化合物が1つだけ生成されるようになります。
なお分子のキラル中心が変わる反応をWalden反転といいます。Walden反転を起こす有機化学反応はいくつかあり、SN2反応はその中の一つです。
立体障害で第三級アルキル基は反応が起こらない
どのようなとき、SN2反応が起こるのでしょうか。SN2反応はメチル基や第一級アルキル基で反応が起こりやすくなっています。第二級アルキル基では反応速度が遅くなり、第三級アルキル基ではSN2反応が起こりません。
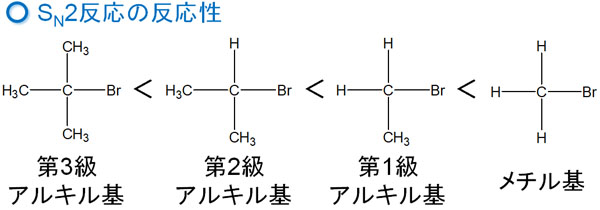
つまり、反応性の順番はSN1反応と逆になると考えましょう。なぜ、第三級アルキル基ではSN2反応が起こらないのでしょうか。これには、立体障害が関与しています。
第三級アルキル基では、多くの置換基が結合しています。求核剤が反対側から攻撃しようとしても、これらの置換基によって求核剤は目的の炭素原子に近づくことができません。その結果、SN2反応は起こらなくなっています。
例えば臭化tert-ブチル(tert-Butyl bromide)に対して、求核置換反応をするとします。この場合、立体障害によってSN2反応は起こりません。しかしブロモエタン(Bromoethane)であれば、SN2反応が起こります。
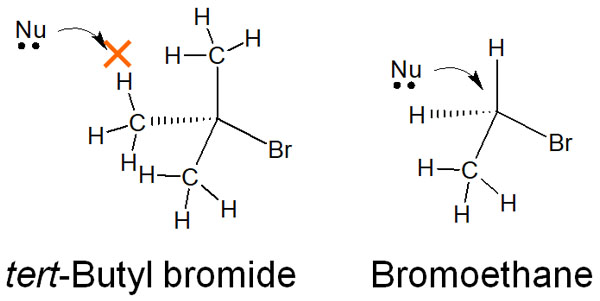
このように構造式を書けば、第三級アルキル基では求核剤がなぜ反対側から攻撃できないのか理解できます。有機化学は立体障害を考える必要があるのです。
なお臭化tert-ブチルでSN2反応は起こらないものの、SN1反応は起こります。これは、前に説明した通りです。
・シクロヘキサンなど、環状化合物は反応性が劣る
参考までに、シクロヘキサンなどの環状化合物ではSN2反応の反応性が他の化合物よりも遅いことが知られています。この理由としては何があるのでしょうか。
シクロヘキサンでは、水素原子による立体障害があると知られています。これを1,3-ジアキシアル相互作用といいます。シクロヘキサンの1位と3位にある水素原子がアキシアルで立体障害を起こすのです。
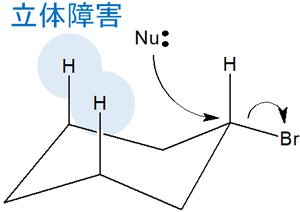
有機化学では、反応速度の違いを立体障害によって説明できることがよくあります。
求核剤と脱離基の種類や濃度によって反応性が異なる
SN2反応の場合、求核剤が反応速度に関与します。SN1反応では、求核剤は律速段階とは関係ありませんでした。ただSN2反応では、求核剤が反対側から攻撃することで反応が起こるため、反応速度に関与するのです。
求核性(塩基性)が強いほど、また求核剤の濃度が濃いほど、SN2反応は起こりやすくなります。つまり、SN2反応の反応速度では2つの要素が関わります。そのため、SN2反応では2の数字が用いられます。
また同じ求核試薬であったとしても、マイナスの電荷を有する化合物であるほど求核性が強くなります。理由は既に述べた通り、塩基性が強いほど求核性が強くなるからです。求核性の順番は以下のようになります。
- CH3O– > CH3OH
- C6H5NH2 > C6H5NH3+
マイナスの電荷をもてば塩基性が強くなるのは当然なので、これについては理解しやすいといえます。なおSN2反応のエネルギー図では以下のようになります。
エネルギーが加えられることで、遷移状態となります。このとき、求核剤と反応化合物の両方が反応性に関わります。
ウィリアムソンエーテル合成はハロゲン置換のSN2反応
これらSN2反応による合成反応は人名反応でも利用されています。有機合成では、発見者の名前を利用した人名反応がたくさんあります。これら人名反応の一つがウィリアムソンエーテル合成です。
ウィリアムソンエーテル合成とは、要はSN2反応によってエーテルを合成する手法だと理解しましょう。そのため、これまでの説明を理解していれば内容は非常に簡単です。アルコールの酸素原子が「ハロゲンが結合している炭素原子」に攻撃し、SN2反応によってエーテルが合成されます。
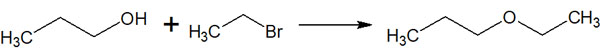
エーテル合成をするとき、ウィリアムソンエーテル合成が頻繁に利用されます。
ただSN2反応はウィリアムソンエーテル合成に限らず、あらゆる有機反応で有益です。アルコールに加えて、他の官能基を有する分子を利用することで、多くの種類の分子を作ることができます。以下のようになります。
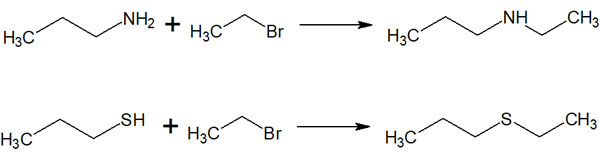
求核置換反応を利用すれば、非常に多くの化合物を合成できるようになります。すべての有機化学者が求核置換反応を利用すると考えましょう。
SN1反応とSN2反応の違いを比較
これらSN1反応とSN2反応を比較したとき、どのような違いがあるのか整理するようにしましょう。まとめると、以下のようになります。
| SN1反応 | SN2反応 | |
| 反応速度 | 反応化合物 | 求核剤と反応化合物 |
| 反応の様子 | 1分子反応 | 2分子反応 |
| 反応回数 | 2段階反応 | 1段階反応 |
| 生成物 | ラセミ体 | 立体反転 |
また第三級や第二級など、結合しているアルキル鎖によってSN1反応なのかSN2反応なのかが違ってきます。これについて、以下のようになります。
| 第三級 | 第二級 | 第一級 | メチル | |
| SN1反応 | ◎ | 〇 | × | × |
| SN2反応 | × | 〇 | ◎ | ◎ |
反応化合物の置換基によって、どの反応が起こるのかが違ってきます。
脱離基(ハロゲンの性質)が反応性に関与する
ちなみにSN1反応とSN2反応に共通するものとして、脱離基が反応性に関与することがあげられます。反応化合物に結合している脱離基の反応性が高いほど、有機合成反応が起こりやすくなります。
どのような脱離基であれば反応性が高いのでしょうか。これについて、脱離基が脱離したあと、安定な状態を取りやすいほど脱離能が高いといえます。脱離した後の化合物(共役塩基)が安定であるほど、脱離基は脱離して自由に動きたいと考えるため、脱離能が高いといえます。
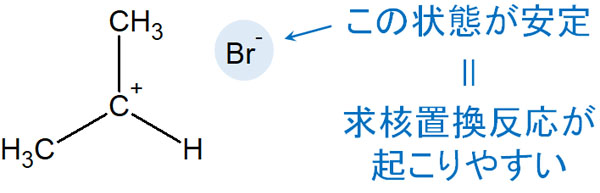
具体的には、どのような分子だと脱離能が高くなるのでしょうか。これについて、脱離することで生成する物質の酸性度が高いほど(塩基性が低いほど)、脱離能が優れているといえます。
強い酸を示す物質であるほど、溶液中ではイオンとして存在する傾向が強いです。そのため、酸性度の高い化合物であるほど脱離した後の状態は安定です。ハロゲンで酸性度を順に表すと以下のようになります。
- HI(ヨウ化水素)>HBr(臭化水素)>HCl(塩化水素)>HF(フッ化水素)
そのため、求核置換反応での脱離能は以下の順番になります。
- I(ヨウ素)>Br(臭素)>Cl(塩素)>F(フッ素)
ヨウ素とフッ素を比べると、フッ素のほうが電気陰性度は高いです。そのためフッ素のほうが分極の度合いが大きく、優れた脱離基となるように思えてしまいます。ただ脱離後の安定性を考えると、酸性度の高いヨウ素のほうが優れているといえます。
溶媒効果による安定性の違い
なお求核置換反応では、使用する溶媒によって反応性が違ってきます。これを溶媒効果といいます。溶媒効果はSN1反応とSN2反応でそれぞれ異なるため、利用する溶媒を見極める必要があります。
有機合成反応で用いる溶媒としては、主に以下の3つがあります。
- プロトン性極性溶媒
- 非プロトン性極性溶媒
- 非極性溶媒
それぞれの溶媒がどのようになっているのか確認していきましょう。
・プロトン性極性溶媒はイオンを強く安定化させる
プロトン性極性溶媒としては、メタノール(CH3OH)やエタノール(CH3CH2OH)、酢酸(CH3COOH)などが知られています。これらの分子は「強くプラスに荷電した水素原子」をもちます。
酸素原子など、電気陰性度の高い原子に水素原子が結合すると、水素原子はプラスの電荷を帯びるようになります。その結果、水素結合を形成できるようになります。分極の中でも、強い分極による結合が水素結合です。
水素結合できる溶媒がプロトン性極性溶媒です。プロトン性極性溶媒では、イオンであればプラスの電荷でもマイナスの電荷でも溶液中で安定するようになります。
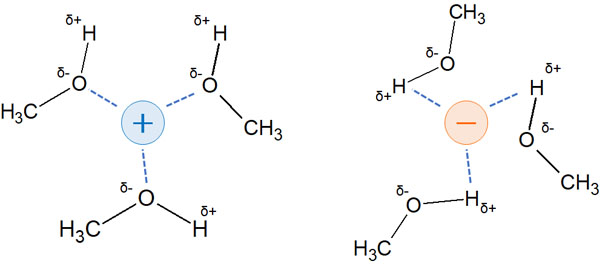
プラスの電荷をもつ分子であれば、マイナスの電荷をもつ溶媒原子と相互作用します。マイナスの電荷をもつ分子であれば、プラスの電荷をもつ水素原子と相互作用します。その結果、溶液に溶けている化合物は安定化します。
求核剤や脱離基では、酸性度や塩基性度が反応性に重要です。これらプロトン性極性溶媒はイオンを強く安定化させると理解しましょう。
・非プロトン性極性溶媒はイオンを弱く安定化する
それに対して、非プロトン性極性溶媒が存在します。酸素原子や窒素原子が分子内に存在するため、非プロトン性極性溶媒は分極しています。しかし酸素原子や窒素原子に水素原子が直接結合しているわけではないため、水素結合することはできません。
こうした化合物が非プロトン性極性溶媒です。非プロトン性極性溶媒には以下が知られています。
- アセトン
- アセトニトリル
- DMF(N,M-ジメチルホルムアミド)
- DMSO(ジメチルスルホキシド)
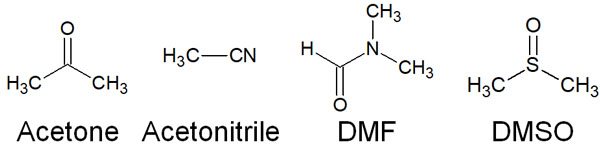
水素結合ではないものの、これらの分子は酸素原子や窒素原子によって分極しています。その結果、弱くイオンを安定化させます。
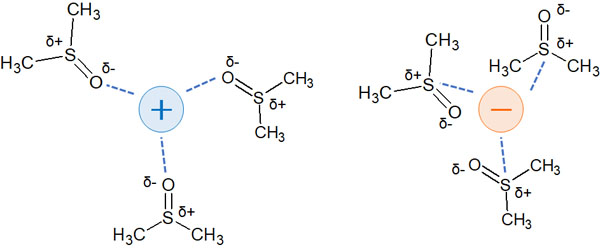
そのため非プロトン性極性溶媒を利用すると、求核剤や脱離基のイオンが少し安定化すると考えましょう。
・非極性溶媒は安定化に寄与しない
アルキル鎖だけの分子であり、極性をもたない溶媒が非極性溶媒です。非極性溶媒には、例えば以下があります。
- ヘキサン
- ベンゼン
- トルエン
これら非極性溶媒は分極していないため、カチオン(プラスの電荷)もアニオン(マイナスの電荷)も安定化することはできません。
SN1反応とSN2反応の起こりやすさは溶媒で異なる
これら溶媒によって性質が異なるため、使用する溶媒によって反応性が変わります。求核置換反応では、以下のようになると考えましょう。
- SN1反応:プロトン性極性溶媒が有利
- SN2反応:非プロトン性極性溶媒または非極性溶媒が有利
なぜ、このような違いがあるのでしょうか。最初にSN1反応から確認していきましょう。
SN1反応の反応性は反応化合物だけに依存します。また脱離基の安定性が優れるほど、カルボカチオンを生成しやすくなって反応速度が上昇します。脱離基が脱離したあと、マイナスのイオンを生じます。このイオンが安定化するためには、分極した溶媒があるとより安定しやすいです。
またカルボカチオンはプラスの電荷をを帯びており、分極している溶媒を利用するとカチオンが安定化されます。そのため、SN1反応は以下の順番で反応が進みやすいです。
- プロトン性極性溶媒 > 非プロトン性極性溶媒 > 非極性溶媒
エネルギー図にすると、以下のようになります。
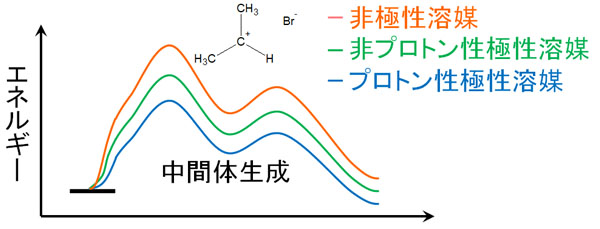
中間体を生成するときに必要な最初の活性化エネルギーが減るため、プロトン性極性溶媒を利用するとSN1反応が起こりやすくなります。
・SN2反応での溶媒効果
それに対して、SN2反応の溶媒効果はどうなっているのでしょうか。SN2反応でも脱離基のイオンが安定化するため、プロトン性極性溶媒のほうが反応性は良いよいに思えてしまいます。
ただ注意点として、SN2反応では求核攻撃を受ける化合物だけでなく、求核剤が反応速度に大きく関与します。プロトン性極性溶媒や非プロトン性極性溶媒を利用すると、求核剤が安定化します。つまり化合物を攻撃する能力が弱くなります。
エネルギー図にすると、以下のようになります。
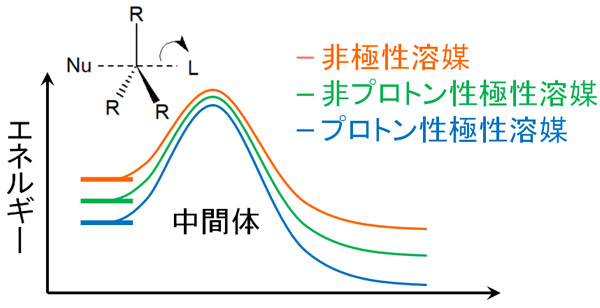
ピーク時の活性化エネルギーは大きな違いがありません。一方、分極している溶媒を使用すると、求核剤(イオン)が安定化されます。その結果、分極している溶媒を利用するほど、反応に必要な活性化エネルギーがたくさん必要になります。
遷移状態になるために多くのエネルギーが要求されます。そのため、SN2反応ではプロトン性極性溶媒を利用しません。非プロトン性極性溶媒または非極性溶媒を使用するのが一般的です。プロトン性極性溶媒を使うと、SN2反応が起こりにくくなるからです。
求核置換反応の起こりやすさを見分ける
有機合成反応の中でも、非常に重要な化学反応が求核置換反応です。すべての有機化学者でSN1反応やSN2反応を利用するといえるほど、利便性の高い合成反応です。脱離基のある化合物と求核剤を混ぜることで、これらが化学反応するのです。
求核置換反応にはSN1反応とSN2反応があります。両者は同じ求核置換反応ですが、特定の条件で反応が起こりやすかったり、起こりにくかったりします。これには、主に以下の要素が関わってきます。
- 反応する化合物の状態(第三級、第一級など)
- 使用する求核剤
- 結合している脱離基
- 合成反応で使う溶媒
これらを見分け、SN1反応とSN2反応のどちらが起こるのか考えましょう。
さらに、立体化学まで考慮したうえで反応性や生成する化合物を予測しなければいけないのが求核置換反応です。これらの反応機構を理解し、有機化合物の合成を行うようにしましょう。






