物理化学や有機化学で学ぶものとして、「電子軌道の状態」があります。電子がどのように存在しているのかを最初に学ぶことで、分子の状態を理解できるようになります。
しかし量子力学として最初に学ぶ電子の状態は抽象的であり、理解するのが異常に難しいです。例えば有機化学を学ぶにしても、電子軌道の状態について深く理解せず、有機化学反応の勉強を進めていこうとする人は非常に多いです。
ただ電子の状態を学ぶからこそ、より深く現象を理解できるようになります。こうした電子の状態を表すものとして、パウリの排他原理やフントの法則があります。
教授によっては、難しい数式を利用してパウリの排他原理やフントの法則を説明するかもしれません。しかし、物理学者でない限りこうした数式を利用するのは意味がありません。そこで数式などは使わず、世の中の現象と比較しながら、分かりやすくパウリの排他原理やフントの法則を解説していきます。
もくじ
量子力学の波動関数は電子の存在確率を表す
量子力学とは、電子や陽子、中性子などの状態を知る学問になります。量子力学では、電子を取り扱うのが代表的です。量子力学の分野では、これまでに何人ものノーベル物理学賞の受賞者を輩出しています。
量子力学では波動関数が出てきます。このとき、波動関数とは何でしょうか。高校化学では、電子が原子の周りを惑星のように回っている様子を習います。
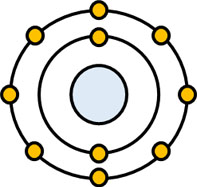
しかし、この図は間違っています。電子は原子の周辺を回っていません。電子は軌道に入っていますが、電子軌道に存在するかどうかは不明です。「電子軌道に存在する確率が高い」といえますが、別の場所に電子が存在することも考えられます。
電子が存在する範囲は電子雲と呼ばれており、電子軌道は「電子の存在する確率が高い場所」でしかありません。そこで、電子がどれくらいの確率でその場所に存在するのか教えてくれるのが波動関数です。
電子は波の一種であるため、波動関数という名前になっています。電子の形や存在確率を示すのが波動関数です。
パウリの排他原理は電子の状態を表す
それでは、パウリの排他原理とは何なのでしょうか。パウリの排他原理は量子力学の一つであり、電子の状態を表します。
パウリの排他原理を非常に簡単に記すと、次のようになります。
- 1つの軌道には、2つの電子しか入らない
電子軌道には種類があります。物理化学や有機化学で特に重要なのは、s軌道とp軌道です。以下のような形をしています。
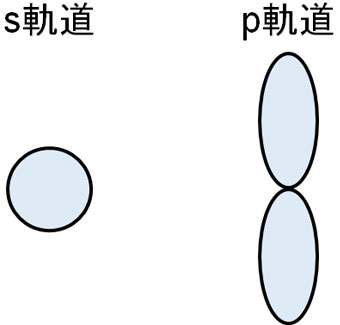
電子はこれらの軌道に存在する確率が高いです。ただ、電子は自由にこれらの軌道に入れるわけではありません。1つの軌道について、最大で2つまでしか電子が入りません。これが、パウリの排他原理です。
1945年、スイスの物理学者であるヴォルフガング・パウリはノーベル物理学賞を受賞しました。彼はパウリの排他原理を発見し、この功績が認められてノーベル物理学賞を受賞したのです。
電子はスピンがあり、互いに反対方向を向かなければいけない
他にも、パウリの排他原理では重要な考え方があります。それは、電子の向きです。電子が軌道に入るとき、どのような方向でもいいわけではありません。互いに反対側を向いた状態でなければ電子軌道に入れません。
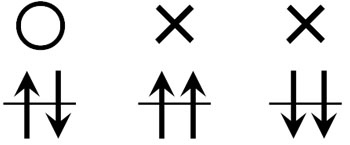
電子はスピンをしており、それ自体が回転しています。また、電子には電荷があります。電荷をもつ物質が回転すると、磁力を生じるようになります。
磁石にはN極やS極があり、同じ向きに入ってしまうと反発します。例えば、N極とN極と近づけると反発します。お互いを打ち消しあうために、電子は同じ向きではなく、反対向きで電子軌道の中に入ります。
もっと正確にいうと、「同じ波動関数をもった電子は、同じ軌道に入ることができない」となります。ただ波動関数という言葉を使うと難しいです。そこで、「同じ方向でスピンしている電子は同じ電子軌道に入れない」と理解すればいいです。
身近にあるパウリの排他原理の事例
こうしたパウリの排他原理は私たちの身近に存在します。例えば、りん光がこれに該当します。以下は日中の太陽の光を吸収し、夜に光を放つ道路です。

光を当てるのをやめたとしても、継続して弱い光を放ち続ける現象がりん光です。蛍光と異なり、光を当てていないにも関わらず、りん光では光をなぜ放ち続けるのでしょうか。これには、パウリの排他原理が関係しています。
電子に光エネルギーが当たると、電子は他の軌道に移動します。これを電子遷移といいます。ただ電子遷移が起こった状態は不安定(励起状態)であり、元の状態(基底状態)に戻ろうとします。このとき、熱や光を放出して基底状態に戻ります。
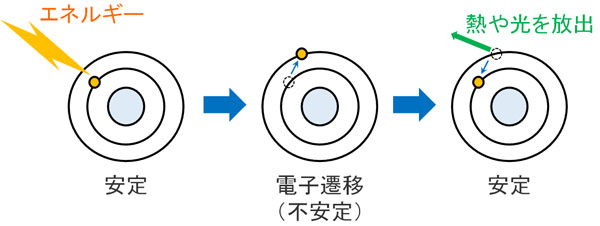
ただ物質によっては、光が当たって電子遷移したあと、電子スピンの向きを変えることがあります。専門用語では、この状態を励起三重項状態といいます。
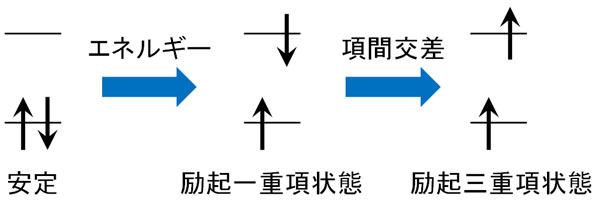
しかしパウリの排他原理によると、同じ波動関数(電子スピン)をもつ電子では、同じ軌道に入ることができません。
電子遷移した後、不安定な励起状態から基底状態に戻るためには、電子スピンの向きを反転させる必要があります。そのため励起状態からすぐに基底状態に戻ることができず、弱い光を長い時間放ち続けるようになります。これがりん光の原理です。
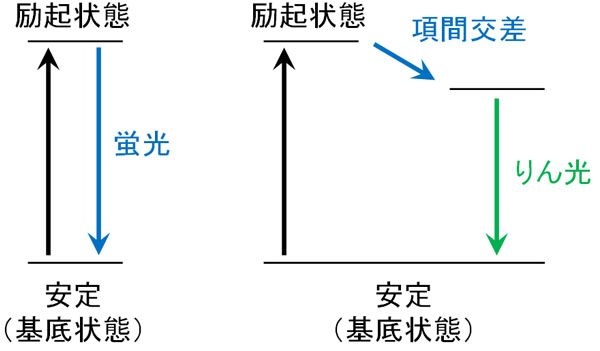
パウリの排他原理を学べば、りん光を生じる理由が分かります。私たちの周りにある現象のいくつかは、パウリの排他原理によって説明できます。
なおパウリの排他原理は電子に限らず、陽子や中性子などであっても例外なく適用されることが分かっています。中には例外はあるものの、多くの物質がパウリの排他原理に従います。
フントの法則(フントの規則)で電子配置を学ぶ
それでは、電子軌道には必ず電子が2つ存在しなければいけないのでしょうか。もちろん、そういうわけではありません。同じ電気軌道に2つの電子が入ると、電子密度が高くなります。電子は互いに反発するため、電子同士は離れて存在したほうがいいです。
そうしたとき、電子が軌道に入るときの順番を示すものにフントの法則(フントの規則)があります。電子配置のルールがフントの法則です。フントの法則では、以下のようになります。
- 電子が軌道に入るとき、別の軌道から順に入る
分子はそれぞれ軌道をもっています。同じエネルギーの軌道が存在するのであれば、電子が軌道に入るとき、それぞれの軌道へ1つずつ入ります。これがフントの法則です。
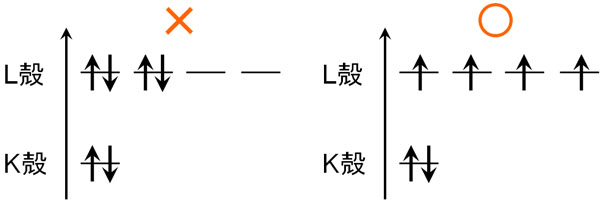
このように、一つずつ電子が入っていきます。
エネルギーの低い軌道から順に電子が入る
しかし、先ほどの電子配置は正しくありません。s軌道とp軌道を考慮していないからです。電子軌道にはs軌道とp軌道が存在します。2つのエネルギーを比較したとき、s軌道のほうがエネルギーは低いです。
同じL殻であっても、p軌道よりs軌道のほうがエネルギーは低いです。その結果、電子は先にs軌道へ2つ入ります。その後、p軌道へ1つずつ入ります。炭素原子や窒素原子、酸素原子について、フントの法則では以下のように電子軌道へ入ります。
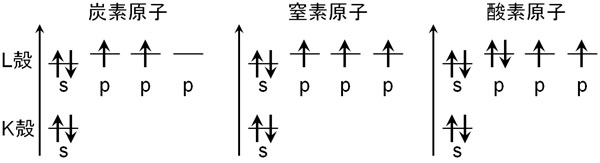
それぞれの原子は以下のように電子を保有しています。
- 炭素原子:6つ
- 窒素原子:7つ
- 酸素原子:8つ
電子がエネルギーの低い順に入ると、上図のようになります。s軌道のほうがエネルギーは低いため、最初はs軌道に2つ電子が入ります。その後、p軌道に電子が入ります。p軌道は3つ存在し、エネルギーは同じです。そのためp軌道に電子が入るとき、1つずつそれぞれの軌道に入っていきます。
こうした規則に従って電子配置します。フントの法則によって電子配置すると、不対電子ができます。フントの法則で電子配置させると、不対電子の数は最大になります。
いずれにしても、こうした原子の電子配置がフントの法則(フントの規則)です。フントの法則を学ぶことで、原子の電子配置やエネルギー、分子の結合を理解できるようになります。
原子・分子に存在する電子の環境を知る
化学で重要な要素に電子の状態があります。電子がどのような状態で存在するのか知るからこそ、化学反応の様子を理解できるようになります。
ただこれら量子力学が難しいのは、有機化学や生化学のように、明確に判別できないことです。例えば生物実験であれば、細胞の様子を確認することができます。しかし、原子や分子の電子を確認するのは困難です。
そのため、どうしても理解しにくいのが量子力学での波動関数です。こうした量子力学にパウリの排他原理やフントの法則があります。
ただ難しい数式を利用しなければ、パウリの排他原理やフントの法則についての概念は簡単です。電子の状態や配置を示す原理がこれらの法則です。
これらの法則に従う理由を知りたい場合、難しい計算が必要になります。その場合は量子力学として、物理を深く学ぶ必要があります。ただ多くの人にとって難解な計算をしてまで理由を知る必要はないため、こうした法則があることを理解したうえで次のステップに進むようにしましょう。






