どれだけ電子(e–)を引き付けるのかを表す指標が電気陰性度です。化学では、電気陰性度は多くの場面で利用されます。電気陰性度が存在することによって、分子が荷電するのです。
電気陰性度によって、分子内で原子がプラスまたはマイナスの性質を帯びるようになります。これにより、極性分子が生まれます。
また電気陰性度によって発生する結合に水素結合があります。電気陰性度によって分子同士が引き合うものの、その中でも「特に強い電気陰性度による力」が水素結合です。水素結合を理解すれば、なぜ水の沸点が他の分子に比べて高いのか理解できます。
分子の性質や化学結合を学ぶとき、電気陰性度は重要です。そこで電気陰性度の性質を解説していきます。
もくじ
電気陰性度とは、電子を引き付ける強さを表す
どれだけ電子を引き付けることができるのかを表すのが電気陰性度です。また、原子が共有電子対をどれだけ強く引っ張れるのかについて、数値化したのが電気陰性度です。
2つの原子が結合して分子を作るとき、電子を共有することによって共有電子対を作ります。このとき、異なる原子で分子が形成されると電気陰性度に違いを生じます。
共有電子対というのは、電気陰性度の強い原子に引っ張られます。そのため、共有電子対は電気陰性度の強い原子の近くに留まります。例えば塩酸(HCl)では、水素原子(H)と塩素原子(Cl)を比べると、塩素原子のほうが強く電子を引き寄せます。
![]()
電子というのは、分子の中で均等に存在しているわけではありません。電気陰性度の影響によって、特定の原子の近くに引っ張られるのです。
元素周期表の右上で電気陰性度が強い理由
それでは、どのような原子について電気陰性度が強いのでしょうか。希ガスを除き、元素周期表の右上で電気陰性度が強いと知られています。
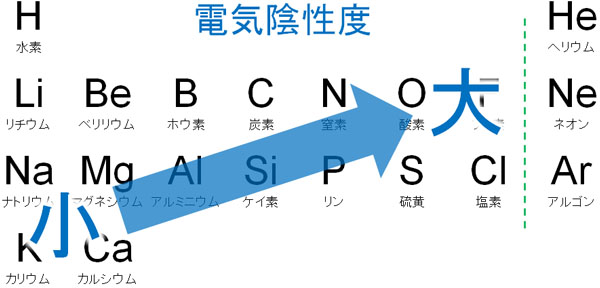
族(元素周期表の上下)では、元素周期表の上にある原子であるほど電気陰性度が強いです。また周期(元素周期表の横)で確認する場合、元素周期表の右側にある原子では電気陰性度が強いです。
電気陰性度が最も強い原子はフッ素(F)です。ハロゲン(フッ素、塩素、臭素など)は電気陰性度が強いことで知られています。また、窒素(N)や酸素(O)も電気陰性度が強いです。
それでは、なぜ元素周期表の右上にある原子は電気陰性度が強いのでしょうか。まず、元素周期表の下にある原子では原子半径が大きくなります。K殻、L殻、M殻の順に原子半径は大きくなります。
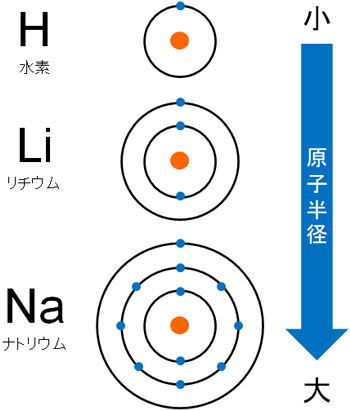
このとき、電子を原子核に引っ張るのは陽子です。ただ陽子からの距離(原子核からの距離)が遠いと、電子を引き付ける力が弱くなります。そのため、元素周期表の下にある原子は電気陰性度が弱いです。
また周期(元素周期表の横)については、原子核の正電荷が強いほど、電子を強く引き付けます。言い換えると、陽子の数が多いほど電子を引き付ける力が強いです。そのため、元素周期表の右側にある原子は電気陰性度が強くなります。
フッ素(F)の近くにある原子であるほど、電気陰性度が強くなります。電気陰性度の強さを覚えるのではなく、理由を理解しましょう。そうすれば、覚えなくても電気陰性度の強さがわかります。
なお希ガスについては、ほかの原子と基本的に共有結合を作りません。そのため、希ガスには電気陰性度が定義されていません。
極性分子は電荷の偏りがある
それでは、分子内の電子の偏りに着目しましょう。原子によって電気陰性度が異なるため、前述の通り分子内で電子が特定の場所に偏ります。
電子(e–)はマイナスの電荷を帯びています。そのため電子が特定の原子に近寄る場合、その原子はマイナスの電荷を帯びることになります。陰イオンのように強いマイナスの電荷を帯びるのではなく、少しだけマイナスの電荷をもつようになります。
「少し」を表すとき、化学ではδ(デルタ)を利用します。そこで、負の電荷を帯びている原子をδ-と表記します。なおマイナスの電荷を帯びる原子がある場合、同時にプラスの電荷を帯びる原子が表れます。そこで、正の電荷を帯びている原子をδ+と表記します。例えば、以下のようになります。
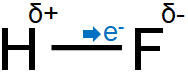
電気陰性度が異なる2つの原子が結合し、分子を作る場合、必ず電荷の偏りがあります。この状態を「極性がある」と表現します。また、極性をもつ分子を極性分子といいます。フッ化水素(HF)や塩化水素(HCl)などは極性分子であり、分子内で電荷の偏りを生じています。
電荷の偏りがない分子は無極性分子
一方、極性をもたない分子も存在します。このような分子を無極性分子といいます。どのような場合に極性をもたないかというと、分子に電荷の偏りがないときが該当します。
例えば酸素分子(O2)を確認しましょう。同じ原子が2つ結合している状態であるため、当然ながら電気陰性度は同じです。そのため電子が特定の原子に近づくことはなく、電子には偏りがありません。
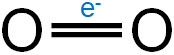
特定の原子に電子が偏っていない場合、無極性分子と判断しましょう。
分子ごとに考える極性分子と無極性分子
2つの原子で構成されている分子の場合、極性分子なのか、それとも無極性分子なのかを見極めるのは簡単です。構成原子が違う場合は極性分子であり、同じ原子で分子が構成されている場合は無極性分子です。
それでは3つや4つ以上の原子で構成されている分子はどのように判断すればいいのでしょうか。実際の例を確認していきましょう。
・二酸化炭素(CO2)
二酸化炭素では、炭素原子と酸素原子が直線でつながっています。炭素原子よりも、酸素原子のほうが電気陰性度は強いです。そのため、電子は酸素原子に強く引き寄せられます。
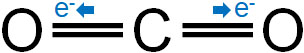
ただ、二酸化炭素は無極性分子です。理由としては、電荷の偏りがないからです。分子全体で考えると、電子は1つの酸素原子に引き寄せられ、もう一方の酸素原子にも引き寄せられています。炭素原子(C)を基準として左右対称の形であるため、電子は特定の原子に偏って存在していないのです。
・水(H2O)
一方、水は極性分子です。この理由としては、水は二酸化炭素のように直線の形ではなく、以下のように折れ曲がった形をしているからです。
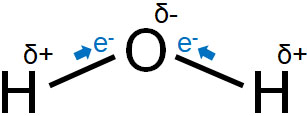
二酸化炭素と同じように、水が直線構造であれば極性はありません。ただ水分子は折れ曲がった形をしているため、O-Hの極性が打ち消されることはなく、結果として極性をもつことになります。
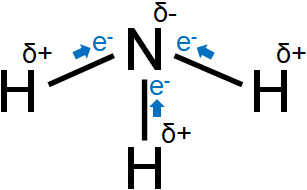
・アンモニア(NH3)
窒素原子(N)に対して、3つの水素原子(H)が結合することでアンモニアを形成します。窒素原子と水素原子を比べると、窒素原子のほうが電気陰性度は強いです。また対称構造ではないため、アンモニアは極性分子です。
・メタン(CH4)
炭素原子(C)に4つの水素原子(H)が結合することによってメタンを形成します。水素原子よりも、炭素原子のほうが電気陰性度は強いです。
ただ、メタンは非極性分子です。メタンは正四面体構造であるため、炭素を中心として対称だからです。
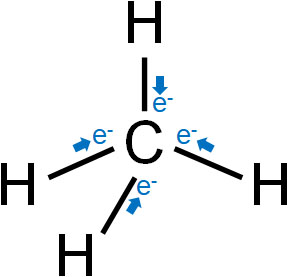
分子全体では、メタンでの電荷は特定の原子に偏っていません。そのため、メタンは無極性分子です。同じように考えると、四塩化炭素(CCl4)も正四面体構造であるため無極性分子です。
電気陰性度が大きい場合、水素結合を作る
なお電気陰性度を学ぶとき、同時に水素結合を理解しましょう。分子を作るとき、原子同士の電気陰性度の差が大きい場合、より強い極性を生じるようになります。
陽イオンと陰イオンが存在すると、イオン結合を作ります。同じように、強い極性をもつ分子については、強い結合を作るようになるのです。これを水素結合といいます。
水素結合の力が強いとはいっても、分子内での電荷の偏りを生じることによる結合です。そのため、陽イオンと陰イオンによるイオン結合に比べると、必然的に結合力は弱くなります。ただ、水素結合であっても比較的強い結合を作るのです。
具体的には、以下のケースで水素結合が作られます。
- F-H結合(フッ素原子と水素原子)
- O-H結合(酸素原子と水素原子)
- N-H結合(酸素原子と水素原子)
![]()
これらのケースの場合、分子内での極性が強いため、分子内で生じた正の電荷と負の電荷で互いに引き付けあいます。強い極性を生じた結果、分子同士で結合を作るのが水素結合です。
イオン結合と水素結合は異なります。ただ、プラスとマイナスの電荷によって引き付け合い、結合を作る点では同じです。イオンではなく、電気陰性度の差によって作られる結合が水素結合です。
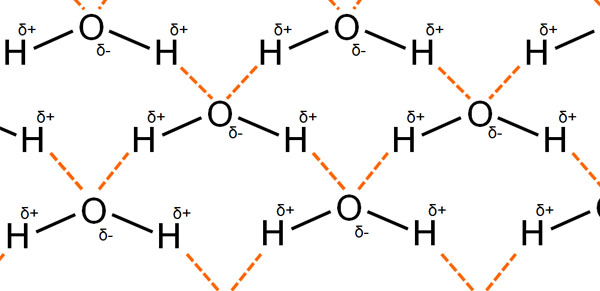
水は強力な水素結合を作るため沸点が高い
電気陰性度と水素結合を理解すれば、なぜ水の沸点が高いのか理解できます。通常、分子量(分子の重さ)が小さい場合、融点や沸点は低いです。事実、酸素や窒素、二酸化炭素は気体です。
二酸化炭素の場合、非極性分子なので互いに引き合う力が弱いです。ドライアイス(二酸化炭素の固体)は非常に低い温度(-78.5℃)でなければ作ることができません。
一方、水が氷になる温度は0℃ですし、沸点は100℃です。分子量が二酸化炭素より小さいにも関わらず、ほかの分子に比べて水の融点や沸点が高いのは、水素結合によって水分子が互いに引き付けあっており、極力な結合を作るからです。
気体と液体を比べると、液体ではそこに多くの分子が凝縮することになります。固体の場合、より分子が凝縮します。凝縮するというのは、分子が互いに引き付けあっていることを意味しています。このとき、前述の通り水は水素結合によって互いに引き付けあう力が強いため、凝縮しやすいです。これが、ほかの分子に比べて水の融点や沸点が高い理由です。
フッ化水素より水のほうが、沸点が高い理由
ここまでの内容を学ぶと、「フッ素(F)のほうが電子陰性度が高いにも関わらず、なぜフッ化水素よりも水のほうが沸点が高いのだ?」と疑問に思う人がいるかもしれません。
酸素原子(O)よりも、フッ素原子(F)のほうが電気陰性度は強いです。つまり、水(H2O)よりもフッ化水素(HF)のほうが水素結合は強力です。それなら、水よりもフッ化水素のほうが融点や沸点は高いと考えるのが自然です。
ただ実際には、フッ化水素よりも水のほうが融点や沸点は高いです。なぜ、このような結果になるのでしょうか。
フッ素には非共有電子対が3カ所あります。ただフッ化水素は1つの水素原子をもつため、結果的に1つのフッ化水素が作れる水素結合は2つです。
![]()
一方、酸素原子には非共有電子対が2ヵ所あります。水が保有する水素原子は2つあるため、結果的に1つの水分子が作れる水素結合は4つになります。
1つの分子が作れる水素結合が2つの場合と4つの場合を比べると、当然ながら水素結合を4つ作れるほうが分子同士の結合は強力になります。分子同士で引き付け合う力が強いというのは、気体ではなく液体または固体として存在しやすいことを意味しています。そのため、水はフッ化水素よりも融点や沸点が高いのです。
参考までに、アンモニア(NH3)の場合だと、1つの分子が作れる水素結合の数は2つです。窒素原子に存在する非共有電子対は1カ所だけです。そのためアンモニアに3つの水素原子があっても、作れる水素結合の数は1つの分子で2つなのです。
電気陰性度と水素結合の性質は重要
原子は陽子をもつため、電子を引き付けます。このとき、原子によって電子を引き付ける力が違います。電気陰性度が最も強い原子はフッ素(F)であり、元素周期表でフッ素の近くにある原子では電気陰性度が高いです。
また電気陰性度の違いによって、分子内に電荷の偏りを生じることがあります。こうした分子を極性分子といいます。一方、電荷の偏りがない場合は無極性分子といわれます。
特に強い極性をもつケースとして、F-H結合、O-H結合、N-H結合があります。これらの結合では、水素結合と呼ばれる強い結合を作ります。イオン結合ほど強い結合ではないものの、分子内の電荷の偏りによって、それぞれの分子が互いに引き合うのです。
電気陰性度と水素結合は化学で重要であり、基本的な内容の一つです。そこで、電気陰性度の性質や水素結合を生じる理由を理解しましょう。