化学反応を起こすとき、熱が放出されたり吸収されたりします。化学では反応熱(化学反応が起こるときの熱)を取り扱います。
反応熱を学ぶとき、すべての人が熱化学方程式を習います。化学反応式を作るときとは方法が異なるため、事前に作り方を理解しましょう。
また熱化学方程式ではヘスの法則を利用したり、結合エネルギーを活用したりすることもあります。ヘスの法則や結合エネルギーを利用すれば、実際に対象の化学反応を起こして実験をしなくても、間接的に反応熱の計算が可能です。
それではどのように熱化学方程式を作り、反応熱の計算をすればいいのでしょうか。ここでは、熱化学方程式の作り方や反応熱の計算方法を解説していきます。
もくじ
発熱反応と吸熱反応の違い
化学反応を起こすとき、発生する熱(または吸収される熱)を反応熱といいます。反応熱の中でも、一般的なのは発熱反応です。
例えばメタン(CH4)を燃やすと熱を発します。なぜ熱を発するかというと、メタンと酸素が反応し、二酸化炭素と水になることで安定な物質になれるからです。
メタンが1mol燃えると891kJの熱が放出されます。なお、熱を取り扱うときはJ(ジュール)を利用します。このとき、熱化学方程式では以下のように記します。
- CH4(気) + 2O2(気) = CO2(気) + 2H2O(液) + 891kJ
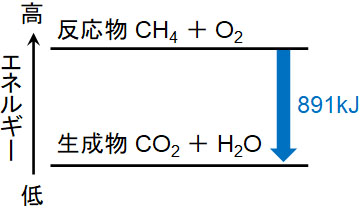
上記の式は「891kJの熱を放出することにより、メタンと酸素が二酸化炭素と水になる」ことを表しています。
物質はエネルギーを保有しています。化学反応によって新たな物質が生まれ、エネルギーの低い化合物へ変化する場合、物質は保有していたエネルギーを放出します。これが反応熱であり、メタンを燃やすと熱が放出されるのです。また、物質は熱を放出するので発熱反応といいます。
・吸熱反応では熱を加える必要がある
一方、熱などのエネルギーを与えることで、エネルギーの低い物質からエネルギーの高い物質へと変換することも可能です。この場合、反応物はエネルギーを吸収することによってエネルギーの高い物質へと変化します。
先ほどの熱化学方程式について、二酸化炭素と水を反応させ、メタンと酸素を得る熱化学方程式を作りましょう。この場合、以下のようになります。
- CO2(気) + 2H2O(液) = CH4(気) + 2O2(気) - 891kJ
なお、マイナスがあると理解しにくいです。そこで-891kJを左辺へ移項しましょう。そうすると、以下のようになります。
- CO2(気) + 2H2O(液) + 891kJ = CH4(気) + 2O2(気)
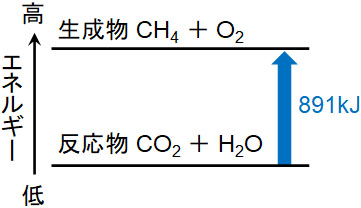
熱化学方程式をみれば、エネルギー(熱)を加えることによって、よりエネルギーの高い物質が生成しているとわかります。熱を吸収することによって反応が進んでいるため、このケースを吸熱反応といいます。
なお、ここまでの解説で以下のことがわかります。
- 発熱反応:熱化学方程式の右辺にあるエネルギーがプラス
- 吸熱反応:熱化学方程式の右辺にあるエネルギーがマイナス
式の右辺に着目し、エネルギーの符号を確認すれば、発熱反応なのか吸熱反応なのかを見分けられるようになります。
反応熱の種類:燃焼熱・生成熱・溶解熱・中和熱
次に反応熱の種類を確認しましょう。化学反応式とは異なり、熱化学方程式の作り方は少し特殊です。熱化学方程式を作るためには、最初に反応熱の種類を見分けなければいけません。主な反応熱の種類は以下になります。
- 燃焼熱
- 生成熱
- 溶解熱
- 中和熱
熱化学方程式を作るとき、基準となる物質の係数を必ず1に設定します。反応熱の種類を見極める際には、「どの物質の係数を1に設定すればいいのか」が重要になります。以下、それぞれの反応熱を確認していきましょう。
・燃焼熱
1molの物質を燃焼するときに発する熱量が燃焼熱です。そこで、燃焼する物質の係数を1にしましょう。先ほど、メタンを燃やすときの熱化学方程式を記しました。メタンの係数を1にしているのは、この反応が燃焼熱に関わっているからです。
- CH4(気) + 2O2(気) = CO2(気) + 2H2O(液) + 891kJ
・生成熱
1molの物質が生成するときに発生、または吸収する熱量を生成熱といいます。生成熱では、生成する物質の係数を1にしましょう。例えば、エチレン(CH2CH2)の生成熱は以下のようになります。
- 2C(黒鉛) + 2H2(気) = CH2CH2(気) - 52.5kJ
・溶解熱
1molの物質が溶媒に溶けるときに発生、または吸収する熱量が溶解熱です。例えば固体の水酸化ナトリウム(NaOH)を水に溶かす場合、以下のようになります。
- NaOH(固) + aq = NaOHaq + 44.5kJ
・中和熱
酸と塩基による中和反応によって1molの水が生まれるときに発生する熱量を中和熱といいます。中和熱ではH2Oの係数を1にします。例えば塩酸と水酸化ナトリウムを中和させるとき、熱化学方程式は以下のようになります。
- HClaq + NaOHaq = NaClaq + H2O(液) + 56.5kJ
・状態変化での発熱反応と吸熱反応
なおここまで解説した反応熱に比べると重要ではないものの、状態変化が関わる反応熱もあります。例えば水が液体から気体になるとき、熱を加える(水が熱を吸収する)ことによって状態変化します。
状態変化での反応熱の種類は以下のようになります。
- 融解熱:1molの固体が溶け、液体になるときに吸収する熱量
- 蒸発熱:1molの液体が蒸発し、気体になるときに吸収する熱量
- 昇華熱:1molの固体が昇華し、気体になるときに吸収する熱量
- 凝縮熱:1molの気体が凝縮し、液体になるときに発生する熱量
- 凝固熱:1molの液体が凝固し、固体になるときに発生する熱量
エネルギーの大きさが「気体>液体>固体」の順であることは誰でも理解できると思います。また固体から液体、液体から気体にするためには熱を与える必要があるため、これらの状態変化は吸熱反応です。また、その反対は発熱反応です。
状態変化での発熱反応や吸熱反応については、身の回りで起こっている実際の現象から解答できるようになりましょう。
熱化学方程式の作り方と反応熱との関係
それでは、実際に熱化学方程式を作りましょう。化学反応式とは作り方が異なるため、熱化学方程式の作り方を理解する必要があります。
熱化学方程式を作る手順は以下になります。
- 化学反応式を作る(→ではなく=で左辺と右辺をつなぐ)
- 着目する物質の係数を1にする
- 反応熱を加え、物質の状態を記す
例として、水素と酸素が反応して水が生成する場面を考えましょう。
・化学反応式を作る(→ではなく=で左辺と右辺をつなぐ)
最初に行うことは化学反応式を作ることです。そこで、以下の化学反応式を作りましょう。
- 2H2 + O2 = 2H2O
注意点として、熱化学方程式を作る場合は→ではなく=を利用して左辺と右辺をつなぎます。
・着目する物質の係数を1にする
先ほどの式は生成熱が関係しています。つまり、水が生成するときの化学反応式です。そこで、H2Oの係数を1にしましょう。
- H2 + \(\displaystyle\frac{1}{2}\)O2 = H2O
反応熱の種類を理解しなければいけない理由としては、どの物質を1にすればいいのか見分けられるようにする必要があるからです。
・反応熱を加え、物質の状態を記す
係数を1にした後、反応熱を加えましょう。水素と酸素の反応では286kJ/molの反応熱です。そのため、右辺に286kJを加えます。さらに、以下のように物質の状態を記しましょう。
- H2(気) + \(\displaystyle\frac{1}{2}\)O2(気) = H2O(液) + 286kJ
こうして、熱化学方程式を作ることができました。
ヘスの法則(総熱量保存の法則)を利用して反応熱を計算する
熱化学方程式を解くとき、ヘスの法則(総熱量保存の法則)はひんぱんに利用されます。ヘスの法則を利用すれば、実験困難なケースであっても反応熱を計算できるようになります。
出発物質と最終生成物が同じ場合、反応熱の総和が同じになる法則をヘスの法則といいます。例えば炭素と酸素が反応すると、二酸化炭素が生まれます。ただ不完全燃焼の場合、二酸化炭素ではなく一酸化炭素(CO)を生成することもあります。
このとき最終生成物が二酸化炭素なのであれば、途中で一酸化炭素を経由したとしても、以下のように合計の反応熱は同じです。

そのため、上図について以下の計算式が成り立ちます。
- Q1 + Q2 = Q3
出発物質と最終生成物が同じであるため、途中の生成過程が違っていても合計の反応熱は同じです。そのためヘスの法則を利用すれば、実験によって測定していないケースであっても反応熱を求めることができます。言い換えると、ヘスの法則を利用すれば連立方程式を解くのと同じように計算できます。
例えば炭素(黒鉛)を燃やすときの燃焼熱(最終生成物が二酸化炭素)は394kJであり、一酸化炭素から二酸化炭素になるときの生成熱は283kJであるとわかっています。このとき、熱化学方程式は以下のようになります。
- C(黒鉛) + O2(気) = CO2(気) + 394kJ
- CO(気) + \(\displaystyle\frac{1}{2}\)O2(気) = CO2(気) + 283kJ
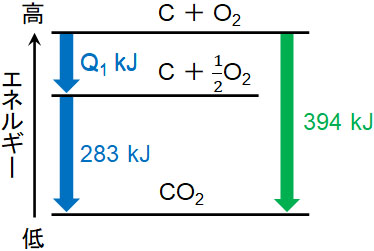
この場合、一酸化炭素(CO)の生成熱はいくらでしょうか。反応熱をQ1とすると、一酸化炭素の生成熱は以下のようになります。
- C(黒鉛) + \(\displaystyle\frac{1}{2}\)O2(気) = CO(気) + Q1kJ
そこで、連立方程式と同じように計算しましょう。

こうして、一酸化炭素の生成熱は111kJであると計算できます。
熱化学方程式の数が3つや4つになっても方法は同じです。連立方程式と同じ方法で足し算と引き算を行い、目的の反応熱を得るようにしましょう。
結合エネルギーを用いる反応熱の計算
なお反応熱を求めるとき、結合エネルギーを利用する方法もあります。結合エネルギーを利用するとなると、難しいように感じます。ただヘスの法則を利用して反応熱を計算する方法よりも計算は簡単です。
結合エネルギーとは、共有結合している分子の結合をバラバラにするときに必要なエネルギーを指します。共有結合が切断されるため、物質のエネルギーは高くなります。つまり熱(エネルギー)を加えることによってエネルギーの高い状態にする必要があるため、吸熱反応になります。
例えばH2(1mol)の共有結合を切断し、2つのHにするために必要なエネルギーは432kJです。また、O2(1mol)の共有結合を切断し、2つのOにするために必要なエネルギーは494kJです。そのため、以下の熱化学方程式となります。
- H2(気) = 2H(気) - 432kJ
- O2(気) = 2O(気) - 494kJ
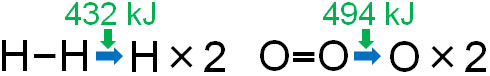
吸熱反応であるため、右辺の反応熱はマイナスになります。または、反応熱を右辺から左辺へ移項して以下の熱化学方程式を作っても問題ありません。
- H2(気) + 432kJ = 2H(気)
- O2(気) + 494kJ = 2O(気)
この熱化学方程式では、水素や酸素にエネルギーを加えることによって共有結合を切断し、高いエネルギー状態の物質を得ることを表しています。
それでは、結合エネルギーを用いて反応熱の計算をしてみましょう。以下の問題の答えは何でしょうか。
- 水素と酸素が反応して水が生成するとき、気体の水(H2O)の生成熱を求めましょう。ただし、結合エネルギーをH-H(432kJ/mol)、O=O(494kJ/mol)、H-O(459kJ/mol)とします。
まず、水の生成熱に関する熱化学方程式を作りましょう。以下のようになります。
- H2(気) + \(\displaystyle\frac{1}{2}\)O2(気) = H2O(気) + QkJ
また、結合エネルギーを用いて以下の熱化学方程式を作りましょう。
- H2(気) = 2H(気) - 432kJ
- O2(気) = 2O(気) - 494kJ
- H2O(気) = 2H(気) + O(気) - 918kJ
H2OにはH-O結合が2つあるため、459kJ/molを2倍する必要があります。また同じ状態で比べるため、H2Oは液体ではなく気体です。これらの結合エネルギーを用いて連立方程式を解けば、反応熱Qを得られます。

こうして、結合エネルギーを利用することによって水(気体)の生成熱を求めることができました。
結合エネルギーを利用して反応熱を求める場合、最初に熱化学方程式を作りましょう。その後、連立方程式を解くことによって答えを得ることができます。
熱化学方程式を作り、反応熱を求める
化学反応式とは異なる作り方になるのが熱化学方程式です。化学反応式を作った後、着目する物質の係数を1に設定しなければいけません。そのため、反応熱の種類を覚える必要があります。
つまり、熱化学方程式を作るときは化学反応式よりも複雑になります。また物質の状態によって反応熱が異なるため、物質の状態も記さなければいけません。
なお熱化学方程式を解くとき、ヘスの法則(総熱量保存の法則)や結合エネルギーがひんぱんに利用されます。連立方程式を解く方法と同じように、足し算と引き算をすることによって物質を消し、反応熱を計算しましょう。
反応熱の計算をするときはルールがあります。化学で反応熱を求めるとき、これらのルールを事前に理解しましょう。