化学反応が起こるとき、反応速度に違いがあります。一瞬で化学反応が終わるケースがあれば、年単位で徐々に化学反応が進行するケースもあります。
それでは、どのように反応速度を計算すればいいのでしょうか。反応速度は濃度や温度、触媒の影響を受けます。また化学反応の種類によって、反応速度式が異なります。そのため、化学反応速度の計算は複雑です。
そこで反応速度式を利用することにより、反応速度を計算できるようになりましょう。また反応速度では活性化エネルギーや反応熱が重要になるため、これらの概念も学びましょう。
化学反応がどれだけ早く起こるのかを知るのは重要です。そこで、化学反応速度の計算方法を解説していきます。
もくじ
分子が衝突することで起こる化学反応
どのように化学反応が起こるのかというと、分子の衝突によって起こります。つまり分子が衝突しなければ化学反応は起こりません。
このとき素早く反応することがあれば、年単位の時間をかけて化学反応が進行することもあります。例えば鉄が酸化されてサビるとき、何年もの時間をかけてゆっくり酸化反応が進行します。もし、鉄が数時間で酸化される性質をもっていればどうでしょうか。この場合、鉄は金属としての利用価値が少ないです。
一方で水素と酸素を反応させて水を得る場合、反応時間は一瞬です。もし、長い時間をかけて水素と酸素が反応する場合、燃料エネルギーの利用として水素は不適です。
このように考えると、なぜ反応速度が重要なのか理解できます。分子が衝突することで化学反応が起こるにしても、反応時間が短いのか、それとも長いのかを知ることによって利用できる場面が異なるのです。
単位時間当たりモル濃度の変化量を確認する
それでは、反応速度はどのように表すのでしょうか。化学反応が起こると、その分だけ生成物の濃度が上昇します。または、化学反応によって反応物の物質量が減少します。
このとき反応速度というのは、特定の時間内(秒:s)にどれだけ生成物のモル濃度(mol/L)が増えたのかを表します。または、特定の反応時間(s)でどれだけの反応物のモル濃度(mol/L)が減ったのかを確認することでも反応速度の計算が可能です。
反応速度を\(v\)(mol/L⋅s)とすると、以下の計算式によって反応速度を得ることができます。

この計算については特に問題なく理解できると思います。例えば反応時間2秒で生成物が3mol/L増えたのであれば、反応速度は1.5mol/L·sです。
なお数学や物理、化学で増減を表すとき、私たちは\(Δ\)を利用します。そのため時間を\(t\)とすると、反応時間は\(Δt\)と表すことができます。このとき、以下の化学反応が起こるとしましょう。
- A + B → C
反応によるAの濃度の減少量を\(ΔA\)と表す場合、Aを基準とする反応速度\(v_A\)は以下のようになります。
\(v_A=\displaystyle\frac{ΔA}{Δt}\)
またBの濃度の減少量を\(ΔB\)と表す場合、Bを基準とする反応速度\(v_B\)は以下のようになります。
\(v_B=\displaystyle\frac{ΔB}{Δt}\)
こうして、化学反応の速度を計算していきます。
なお先ほどの化学反応式では、Aが1mol反応する場合、Bも1mol反応します。つまり、同じ物質量の化合物が反応します。\(ΔA=ΔB\)であるため、\(v_A=v_B\)となります。
反応速度の計算では化学反応の係数に着目する
ここまで、単純な化学反応式を想定して反応速度を説明してきました。ただ実際には、着目する物質によって反応速度が異なることはよくあります。
例えば窒素と水素を反応させ、アンモニアを得る場面を考えてみましょう。化学反応式は以下のようになります。
- N2 + 3H2 → 2NH3
窒素分子が1mol反応するとき、水素分子は3mol反応しなければいけません。前述の通り、反応速度ではモル濃度(物質量)が分子になります。そのためN2の反応速度が\(v\)の場合、H2の反応速度は\(3v\)になります。
またアンモニアに着目すると、窒素分子が1mol反応するとき、アンモニアは2mol生成されます。そのため、NH3の反応速度は\(2v\)です。
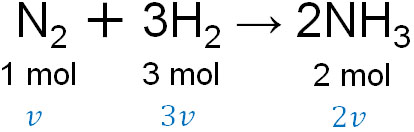
反応速度は化学反応式の係数に比例するとわかります。そのため反応速度を計算するとき、物質量だけでなく、化学反応式の係数にも着目しましょう。
反応速度は濃度、温度、触媒の影響を受ける
なお反応速度は複数の要因によって決まります。一つの要素で反応速度が決まるわけではなく、条件が違えば反応速度は変わります。反応速度に大きな影響を与える要素としては、例えば以下が知られています。
- 反応物の濃度
- 温度
- 触媒
前述の通り、化学反応は分子同士の衝突によって起こります。そのためモル濃度の低い溶液では、分子が衝突する確率は低く、化学反応が起こりにくいです。一方、モル濃度が高いと効率的に分子が衝突して化学反応を起こします。そのため、反応物の濃度は反応速度に大きな影響を与えます。
また温度も重要です。温度が高い場合、分子は活発に動きます。また、温度が高いと分子が動くときのスピードも速いです。そのため温度が高いほど、反応速度は速くなります。
ほかには、化学反応を促す触媒の存在も反応速度への影響が大きいです。反応するために必要なエネルギーを下げるのが触媒です。反応に必要なエネルギーが低いと、低温であっても反応が効率よく進みます。
なお、ほかにも反応速度に関与する要素は存在します。化合物は溶媒に溶けることで分子同士が衝突し、化学反応を起こします。そのため固体を事前に細かく砕いたり、適度に撹拌したりすることによって反応速度が上昇します。
場合によっては光を当てたり、超音波を当てたりすることによって反応速度が上昇することもあります。ただ一般的には、反応速度で重要なのは化合物の濃度や温度、触媒です。
反応速度式と反応速度定数を用いた計算
それでは、実際に反応速度式を利用して化学反応の速度を表してみましょう。前述の通り、反応速度にはモル濃度(物質量)だけでなく、温度や触媒も大きく関与します。
ただ要素が多いと計算が複雑になるため、温度が一定であり、触媒を用いない場面を考えましょう。つまり、変化するのはモル濃度だけです。このとき、以下の化学反応式で反応が進行するとします。
- A + B → C
[A]と[B]をそれぞれの物質のモル濃度とするとき、以下が反応速度式になります。
- \(v=k[A]^a[B]^b\)
恐らく、この式をすぐには理解できないと思います。ただ、ひとまずこの式を用いることで化学反応が起こる速度を表すことができると考えましょう。
\(k\)は比例定数であり、反応速度定数と呼ばれます。化学反応の種類によって\(k\)の値は異なります。そのため、実際に実験をすることで\(k\)の値を求める必要があります。また、化学反応の種類が違えば\(k\)の値は大きく変わります。
さらには、\(a\)や\(b\)の値も不明です。実験によって反応速度を測定しなければ、\(a\)や\(b\)の値を出すことができません。そのため\(a=0\)のときがあれば、\(a=2\)のときもあります。化合物の反応速度というのは、実験をして測定しないとわからないのです。
化学反応の反応次数を確認する
まず、次数に着目して反応速度を確認しましょう。反応速度\(v\)を計算するとき、反応物の濃度(AとBの濃度)の何乗に比例するのかを表すのが反応次数です。
そこで、最初に反応次数が1のときを確認しましょう。
・\(a=1,b=0\)または\(a=0,b=1\)の場合:1次反応(反応次数は1)
反応次数が1の場合、\(a=1,b=0\)または\(a=0,b=1\)になります。この場合を1次反応と呼び、以下のようになります。
- \(v=k[A]\)
- \(v=k[B]\)
これはつまり、反応速度が[A]または[B]の濃度で決定されることを意味しています。例えば反応速度が[A]の濃度によって決まる場合、[B]の濃度は反応速度に寄与しません。
・\(a=2,b=0\)または\(a=1,b=1\)または\(a=0,b=2\)の場合:2次反応(反応次数は2)
一方、次数が2になることもあります。この場合は2次反応と呼ばれます。2次反応では以下のようになります。
- \(v=k[A]^2\)
- \(v=k[A][B]\)
- \(v=k[B]^2\)
\(v=k[A]^2\)の場合、[B]の濃度は反応速度に関与しません。ただ、[A]の2乗によって反応速度が決まります。一方、\(v=k[A][B]\)では[A]と[B]の両方の濃度が反応速度に関わります。
つまり、2次反応には3つの種類があると理解しましょう。また前述の通り、\(k\)や\(a\)、\(b\)は実際に実験して確かめなければわかりません。そのため反応速度式が\(v=k[A][B]\)になることがあれば、\(v=k[B]^2\)になることもあります。
参考までに、\(v=k[A]^2[B]\)は3次反応になります。3次反応では、反応速度式はさらに複雑になります。
実験を行い、反応速度を計算する
実験をすることで反応速度を計算するとき、どのように反応速度式を作ればいいのでしょうか。例として、以下の化学反応を考えてみましょう。
- H2 + I2 → 2HI
この反応について、反応速度\(v\)は以下の式で表されるとわかっています。
- \(v=k[H_2][I_2]\)
※[H2]は水素濃度、[I2]はヨウ素濃度
この反応速度式では、H2とI2の2つの濃度が反応速度に関与しているとわかります。そのためH2の濃度が2倍になれば、反応速度は2倍になります。またI2の濃度が3倍になれば、反応速度は3倍になります。
それではH2の濃度が2倍、I2の濃度が3倍になるとどうなるでしょうか。この場合、ヨウ化水素の生成速度は6倍になります。
なお、実際に実験を行って反応速度のデータを得たとき、反応速度式を作れるようになりましょう。以下の問題の答えは何でしょうか。
- 「A + B → C」で表される化学反応について、AとBの濃度を変えてCの生成速度を求めたところ、以下の結果を得られました。
| 実験 | [A] mol/L | [B] mol/L | \(v\) mol/L·s |
| 1 | 0.5 | 0.4 | 2.0×10-2 |
| 2 | 0.5 | 1.2 | 1.8×10-1 |
| 3 | 1.0 | 0.4 | 4.0×10-2 |
- 反応速度式を\(v=k[A]^a[B]^b\)と表すとき、\(a\)と\(b\)を求めましょう。
- 反応速度定数\(k\)を求めましょう。
- [A]=0.4mol/L、[B]=0.2mol/Lのとき、反応速度を求めましょう。
1)
実験1と実験2に着目すると[A]の濃度は同じである一方、[B]の濃度は3倍になっています。このとき、Cの生成速度は9倍(32倍)になっています。そのため、\(b=2\)です。
同様に実験1と実験3に着目すると、[B]の濃度は同じである一方、[A]の濃度は2倍になっています。このとき、Cの生成速度は2倍(21倍)になっています。そのため、\(a=1\)です。こうして、以下の反応速度式を得られます。
- \(v=k[A][B]^2\)
2)
どの実験でもいいので、先ほどの反応速度式に値を代入しましょう。実験3を利用すると以下のようになります。
\(4.0×10^{-2}=k×1×0.4^2\)
\(k=0.25\)
こうして、反応速度式は\(v=0.25[A][B]^2\)であるとわかりました。
3)
\(v=0.25[A][B]^2\)へ[A]=0.4と[B]=0.2を代入しましょう。以下のようになります。
\(v=0.25×0.4×0.2^2\)
\(v=4.0×10^{-3}\)
こうして、反応速度は4.0×10-3mol/L·sになります。
活性化エネルギーと反応熱の関係
ここまで、濃度に着目して反応速度を確認してきました。次に温度と触媒について確認しましょう。
化学反応が起こるためには、一定以上のエネルギーを与えなければいけません。つまり、反応が起こるには熱などのエネルギーが必要です。どれだけ濃度が濃くしても、エネルギーがなければ反応は起こりません。
このとき、化学反応を起こすために必要なエネルギーを活性化エネルギーといいます。活性化エネルギーよりも大きなエネルギーを与えないと化学反応は起こらないのです。
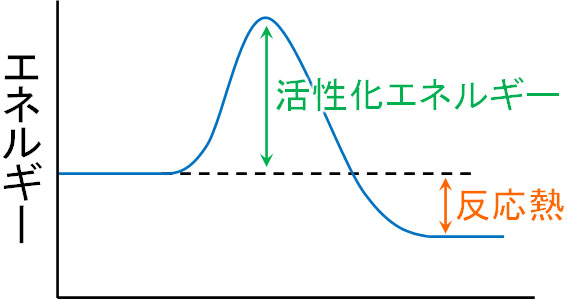
また多くの場合、化学反応の後は安定な物質へと変化します。化学反応によって反応物が生成物へと変換され、低エネルギーの物質へと変化するとき、熱を放出します。このとき放出される熱を反応熱といいます。
活性化エネルギーを超える方法として、温度を高くすることで熱エネルギーを大きくする方法があります。またこのような方法以外に、触媒を加える方法があります。触媒を加える場合、活性化エネルギーが低くなります。
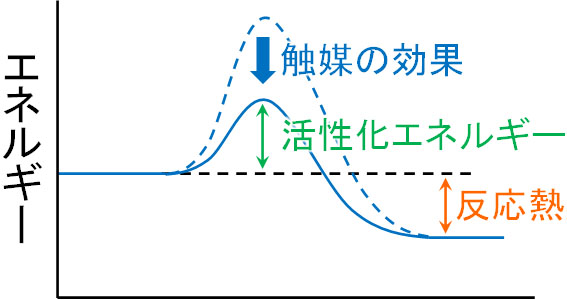
反応熱は変化しません。ただ触媒を加えることによって活性化エネルギーが低くなるため、少しのエネルギーを加えることによって化学反応が進行します。これが、触媒を加えることで反応速度が速くなる理由です。
化学反応での反応速度式を計算する
化学反応の速度を知ることは重要です。反応速度が速いのか、それとも遅いのかを知ることによって、どのような場面で化学反応を応用できるのか決定できます。
化学反応の速度で特に重要な要素が濃度や温度、触媒です。なお反応速度を計算するとき、温度や触媒の条件を変えずに行います。そこで濃度が変化するとき、反応速度式を作れるようになりましょう。
また温度と触媒が反応速度に関わる理由を理解するためには活性化エネルギーを学ぶ必要があります。温度が高いと活性化エネルギーを超えやすくなり、触媒を加えると活性化エネルギーが下がります。反応熱は同じであるものの、活性化エネルギーが反応速度に関与するのです。
化学反応によって反応速度が異なり、実際に実験してデータを測定しなければ反応速度はわかりません。そこで実際のデータを利用し、反応速度式を使って反応速度を計算できるようになりましょう。






