元素周期表の一番左にある元素の中で、水素を除いた元素をアルカリ金属といいます。アルカリ金属は金属元素になります。
アルカリ金属にはリチウム(Li)やナトリウム(Na)、カリウム(K)、ルビジウム(Rb)、セシウム(Cs)、フランシウム(Fr)があります。この中で重要な元素はリチウム(Li)、ナトリウム(Na)、カリウム(K)の3つです。
また無機化学でアルカリ金属を学ぶとき、最も重要な元素がナトリウムです。そこで、アルカリ金属ではナトリウムを含む化合物を重点的に学びましょう。その後、リチウムとカリウムの性質を覚えるといいです。
アルカリ金属には独自の特徴があります。そこで、アルカリ金属の性質を解説していきます。
もくじ
単体の金属ナトリウムの特徴
まず、アルカリ金属が元素周期表のどこに位置しているのか確認しましょう。前述の通り、元素周期表の一番左に位置するのがアルカリ金属です(水素を除く)。

アルカリ金属で最も重要な元素がナトリウムです。ナトリウムを含め、アルカリ金属はイオン化傾向が強いです。そのため金属単体ではなく、ナトリウムはイオンで存在したいと考えています。
ナトリウムはイオン化傾向が強いため、反応性が非常に高いです。例えば空気中の酸素と反応し、酸化されます。
- 4Na + O2 → 2Na2O
またナトリウムを水に入れると、水素と水酸化ナトリウムを発生させます。
- 2Na + 2H2O → 2NaOH + H2
なお実際には、ナトリウムは反応性が非常に強いため、空気中に置くと自然発火しますし、水に入れると発生した水素が酸素と反応して爆発します。そのため、ナトリウムを保存するときは空気や水に触れるのを防ぐため、石油中に保存します。
・融解塩電解によってナトリウムを得る
ナトリウムを含め、アルカリ金属を得る場合は融解塩電解を利用します。金属を得るとき、一般的には水に溶かして電気分解をします。ただナトリウムはイオン化傾向が高く、水とすぐに反応するため、水を利用する電気分解ではナトリウム単体を得ることができません。
そこで、塩(えん)を高熱で融解します。例えば塩化ナトリウムを高温で融解し、液体にします。その後、電気分解することによってCl2とNaを得ることができます。そこで析出したNaを集めることにより、金属ナトリウムを得られます。
水酸化ナトリウム(NaOH)は強塩基であり、潮解性がある
強塩基としてひんぱんに利用される化合物が水酸化ナトリウムです。水酸化カリウムも強塩基として有名ではあるものの、水酸化ナトリウムのほうが利用されます。
水酸化ナトリウムは白色の固体であり、NaCl水溶液を電気分解することによって得られます。具体的には、イオン交換膜法によって得られるのが水酸化ナトリウムです。陽イオン交換樹脂で仕切り、陰極側に純水、陽極側にNaCl水溶液を入れます。
この条件によって電気分解すると、陰極側では水酸化物イオンが発生し、陽極側では塩素が発生します。
- 陰極側:2H2O + 2e– → 2OH– + H2
- 陽極側:2Cl– → Cl2 + 2e–
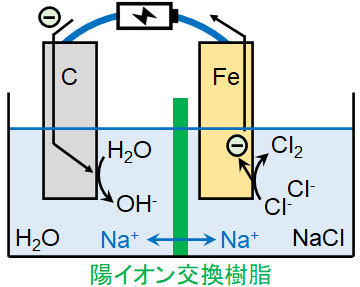
陰イオンは陽イオン交換樹脂を通過できません。一方、Na+は陽イオン交換樹脂を通過できます。陽極側では陰イオン(水酸化物イオン)が生成される一方、陰極側ではCl–がCl2になることで陰イオンが減ります。そのためNa+は陰極側へ移動し、NaOHを得られます。
また、水酸化ナトリウムには潮解性があります。空気中の水分を吸い、固体が液状になることを潮解性といいます。水酸化ナトリウムは潮解性があるため、空気中に放置してはいけません。
炭酸ナトリウム(Na2CO3)とアンモニアソーダ法(ソルベー法)
次に炭酸ナトリウムの性質を学びましょう。炭酸は弱酸であり、水酸化ナトリウムは強塩基であるため、炭酸ナトリウムは水に溶けると弱塩基性を示します。
また炭酸ナトリウムを水から析出させると、Na2CO3·10H2Oとして得られます。ただ、炭酸ナトリウムの水和物を空気中に放置すると、10水和物から1水和物(Na2CO3·1H2O)になります。この現象を風解といいます。
先ほど、水酸化ナトリウムには潮解性があると解説しました。これと反対の作用(空気中に放置することで水が分子外へ放出される現象)が風解です。
・アンモニアソーダ法(ソルベー法)で炭酸ナトリウムを得る
炭酸ナトリウムを得るとき、工業的製法(大量生産する方法)としてアンモニアソーダ法(ソルベー法)が利用されます。アンモニアソーダ法で重要となる化学反応が以下になります。
- NaCl + NH3 + CO2 + H2O → NH4Cl + NaHCO3
このとき生成する炭酸水素ナトリウム(NaHCO3)を熱することによって炭酸ナトリウムを得られます。
- 2NaHCO3 → Na2CO3 + H2O + CO2
なおアンモニアソーダ法では、副生成物を再利用します。最初の化学反応では、炭酸水素ナトリウムだけでなく、塩化アンモニウム(NH4Cl)も生成しています。そこで塩化アンモニウムと酸化カルシウム(CaO)を反応させ、アンモニアを得ましょう。
- 2NH4Cl + CaO → CaCl2 + H2O + 2NH3
なお酸化カルシウム(CaO)を得るとき、炭酸カルシウム(CaCO3)を熱することによって得られます。
- CaCO3 → CaO + CO2
重要なのは、炭酸カルシウムを熱すると酸化カルシウムだけでなく、二酸化炭素も得られることです。
アンモニアソーダ法によって炭酸水素ナトリウムを得るとき、二酸化炭素も必要です。このときの二酸化炭素は、炭酸カルシウムを熱することで放出される二酸化炭素を利用します。
無機化学でアンモニアソーダ法(ソルベー法)を学ぶとき、主反応だけでなく、副生成物の再利用に関わる反応も理解しましょう。
炭酸水素ナトリウム(NaHCO3)は過熱や酸によってCO2を生成する
炭酸水素ナトリウムは重曹とも呼ばれています。料理で炭酸水素ナトリウムを利用することは多く、例えばベーキングパウダーの主成分は炭酸水素ナトリウムです。
先ほど解説した通り、炭酸水素ナトリウムを熱すると炭酸ナトリウムが生成されます。同時に二酸化炭素(CO2)が発生します。炭酸水素ナトリウムを熱すると気体(二酸化炭素)が発生するため、焼き菓子やパンを作るときにベーキングパウダーを利用するとガス(二酸化炭素)が発生して膨張するのです。
- 2NaHCO3 → Na2CO3 + H2O + CO2
また、炭酸水素ナトリウムは塩酸などの強酸と反応することによっても、二酸化炭素が生成されます。
炭酸イオンは弱酸であり、ナトリウムは強塩基由来です。そのため強酸を加えると、強酸由来のイオンと強塩基由来のイオンが結合し、弱酸が遊離します。
- NaHCO3 + HCl → NaCl + H2O + CO2
なお炭酸(H2CO3)が弱酸として遊離する場合、炭酸は水と二酸化炭素に分解されます。炭酸飲料水に振動を与えると大量の二酸化炭素が発生することからわかる通り、水に存在する炭酸は二酸化炭素になって放出されやすいのです。
なお炭酸水素ナトリウムは胃薬としても利用されます。胃潰瘍の原因は過剰な胃酸(塩酸)です。そこで炭酸水素ナトリウムを飲むと、中和反応によって胃酸(塩酸)を少なくできます。中和反応で発生する気体は二酸化炭素と無毒なので、炭酸水素ナトリウムは医薬品としても利用されるのです。
リチウムとカリウムの性質
アルカリ金属で重要なのはナトリウムであり、ナトリウムに比べるとリチウムやカリウムは重要ではありません。またナトリウムの性質を理解すれば、無機化学で理解するべきリチウムとカリウムの性質を覚えるのは簡単です。
金属リチウムや金属カリウムを得たい場合、融解塩電解を利用します。アルカリ金属はイオン化傾向が強いため、水溶液を利用しても金属単体を得ることができないからです。またイオン化傾向が強いため、金属ナトリウムと同様に、金属リチウムや金属カリウムは石油中に保存する必要があります。
またアルカリ金属は水と反応することによって、強塩基を示すようになります。例えば、カリウムが水と反応すると強塩基である水酸化カリウムが生成されます。
- 2K + 2H2O → 2KOH + H2
このように、無機化学でのリチウムとカリウムの性質はナトリウムと似ています。そのためナトリウムの性質を覚えれば、リチウムやカリウムの性質も理解できます。
ナトリウムをメインにアルカリ金属の性質を学ぶ
アルカリ金属は重要な元素です。その中でも、無機化学で特に重要な元素がナトリウムです。アルカリ金属ではリチウム、ナトリウム、カリウムが重要になるものの、ナトリウムの性質をメインに覚えましょう。
ナトリウムは私たちにとって最も身近な元素の一つです。そこで金属ナトリウムだけでなく、水酸化ナトリウムや炭酸ナトリウム、炭酸水素ナトリウムの性質を理解しましょう。
なお金属ナトリウムの性質を理解すれば、リチウムやカリウムの性質を覚えるのは簡単です。無機化学では、リチウムやカリウムの性質はナトリウムと基本的に同じです。
無機化学で必ず学ぶ内容がアルカリ金属です。アルカリ金属を学ぶとき、金属ナトリウムやナトリウムを含む化合物について、性質や製法を答えられるようにしましょう。