酸化還元反応において相手を酸化させる物質が酸化剤であり、相手を還元させる物質が還元剤です。酸化剤や還元剤を利用すれば、酸化還元反応が起こります。このとき、まずは酸化剤と還元剤の種類として何があるのか把握しましょう。
その後、酸化還元反応の式を作れるようにならなければいけません。酸化還元反応の式を作るとき、電子の数に着目しましょう。
また酸化還元反応の式を作れるようになれば、酸化還元滴定での計算をすることができます。酸化剤(または還元剤)を利用することによって、溶液中に溶けている物質の濃度を測定するのです。そこで、酸化還元滴定の計算問題を解けるようになりましょう。
電子の動きを考える必要があるため、酸化還元反応は少し複雑です。そこで、どのように酸化還元反応の式を作り、酸化還元滴定の問題を解けばいいのか解説していきます。
もくじ
酸化剤と還元剤の概要
酸化還元反応では、一つの反応の中で酸化と還元が起こっています。酸化還元反応では反応の前後で酸化数が変化し、電子が動いているのです。電子を放出する場合は酸化であり、電子を得る場合は還元です。
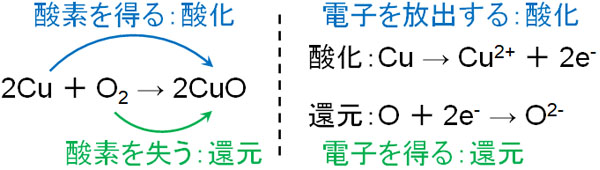
このとき、酸化剤と還元剤を理解しましょう。酸化剤は相手を酸化させる働きがあります。相手を酸化させるというのは、自分は還元されることを意味します。
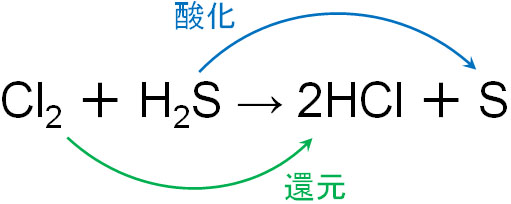
例えば塩素分子(Cl2)などのハロゲンは酸化剤であると知られています。ハロゲンは酸化剤であるため、自身は還元され、塩素と反応する化合物は酸化されます。
一方で還元剤では、相手を還元させる能力が高いです。相手を還元させるとき、自分は酸化されます。酸化剤や還元剤の種類を覚えていれば、酸化数を数えなくても、酸化されているのか還元されているのか容易に判断できます。
有名な酸化剤と還元剤を覚える
化学で酸化還元反応を学ぶとき、酸化剤と還元剤には多くの種類があることに気が付きます。その中でも、有名な酸化剤と還元剤を覚えるようにしましょう。酸化剤と還元剤を覚えていない場合、酸化還元反応の問題を解くことができません。そのため、化合物を覚えるのは必須です。
酸化還元反応が起こるときの式を覚える必要はありません。分子やイオンについて、酸化剤なのか、それとも還元剤なのか区別できるようにしましょう。また、酸化還元反応が起こった後の生成物を覚えておくのは重要です。
具体的には、以下の種類を覚えましょう。
・酸化剤
| 酸化剤の種類 | 反応後の化学式 |
| 過マンガン酸カリウム:KMnO4 | Mn2+ |
| 酸化マンガン:MnO2 | Mn2+ |
| 二クロム酸カリウム:K2Cr2O7 | Cr3+ |
| ハロゲン:X2(塩素など) | X–(Cl–など) |
| 濃硝酸:HNO3 | NO2 |
| 濃硫酸:H2SO4 | SO2 |
| 過酸化水素:H2O2 | H2O |
| 二酸化硫黄:SO2 | S |
・還元剤
| 還元剤の種類 | 反応後の化学式 |
| 水素:H2 | H+ |
| 硫化水素:H2S | S |
| シュウ酸:(COOH)2 | CO2 |
| ナトリウム:Na | Na+ |
| 塩化スズ:SnCl2 | Sn4+ |
| 過酸化水素:H2O2 | O2 |
| 二酸化硫黄:SO2 | SO42- |
過酸化水素(H2O2)と二酸化硫黄(SO2)は酸化剤にも還元剤にもなることができるので注意しましょう。
なお酸化剤の中でも、マンガン(Mn)とクロム(Cr)を含む化合物は酸化剤として非常に重要です。酸化還元反応でマンガンやクロムを含む化合物が提示されている場合、酸化剤であると認識しましょう。
参考までに、酸化剤と還元剤の見分け方としては、覚えるしか方法がありません。酸化還元反応というのは、酸化剤と還元剤による反応です。どれが酸化剤でどれが還元剤か覚えていれば、ようやく見分けることができます。
酸化還元反応の式の作り方:酸化剤・還元剤の半反応式
それでは、実際に酸化剤と還元剤による酸化還元反応の式を作りましょう。酸化還元反応の式の作り方としては、半反応式を利用します。
半反応式とは、酸化剤のみ(または還元剤のみ)に着目するときの化学反応式を指します。酸化剤や還元剤の反応をすべて覚えるのは大変です。そこで半反応式を利用すれば、覚える内容を最小限に抑えることができます。
例として、以下の問題を解きましょう。
- 過マンガン酸カリウムとシュウ酸が反応するとき、酸化還元反応の式を作りましょう。
半反応式では、反応に関係している部分だけを記します。また、酸化剤または還元剤のどちらか一方だけに着目します。その後、以下の順番で半反応式を作りましょう。
- 反応物と生成物を記載する
- 水(H2O)を加える
- 水素イオン(H+)を加える
- 電子(e–)を加える
これにより、半反応式が完成します。まず、過マンガン酸カリウムとシュウ酸のうち、酸化剤である過マンガン酸カリウムに着目しましょう。
・過マンガン酸カリウム(酸化剤)
KMnO4が水に溶解すると、カリウムイオンK+と過マンガン酸イオンMnO4–に電離します。そのため過マンガン酸カリウムが酸化剤として働くとき、反応前の化学式(MnO4–)と反応後の化学式(Mn2+)を覚えておく必要があります。覚えていない場合、半反応式を作ることはできません。いずれにしても、以下の式を作りましょう。
- MnO4– → Mn2+
次に水(H2O)を加えます。左辺にMnO4–があるため、右辺に4つのH2Oを加えればいいとわかります。
- MnO4– → Mn2+ + 4H2O
次は水素イオン(H+)を加えます。以下のように、左辺と右辺で水素原子の数を合わせましょう。
- MnO4– + 8H+ → Mn2+ + 4H2O
最後に電子(e–)を加えます。イオンの電荷を確認すると以下のようになります。
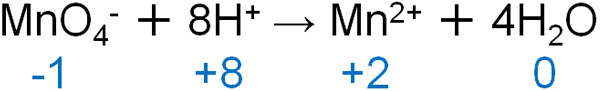
左辺の電荷は合計で+7であり、右辺の電荷は+2です。そのため左辺に5つのe-があれば電子の数が合います。
- MnO4– + 8H+ + 5e– → Mn2+ + 4H2O
こうして、半反応式が完成しました。
・シュウ酸(還元剤)
同様の方法によって、シュウ酸についても半反応式を作りましょう。先ほどと同じやり方をすると以下のようになります。
- (COOH)2 → 2CO2
- (COOH)2 → 2CO2 + 2H+
- (COOH)2 → 2CO2 + 2H+ + 2e–
シュウ酸の場合、H2Oを利用しなくても左辺と右辺で原子の数が合っています。そのため、化学反応式の中にH2Oは含まれません。
半反応式を作るとき、このように反応前の化学式と反応後の化学式を記入し、H2OやH+、e–を加えていきましょう。
電子の数をそろえ、酸化還元反応の式を作る:イオン反応式
酸化剤と還元剤でそれぞれ半反応式を作ることができたら、次は2つの半反応式を合体させましょう。方法としては、電子e–の係数を合わせます。化学反応式を完成させるとき、式の中に電子が表れることはありません。そこで、電子の係数を同じにするのです。
そこで先ほどの式について、以下のようにかけ算を行い、合体させましょう。
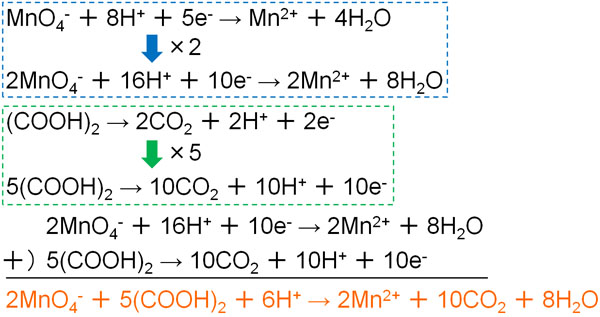
電子の係数を同じにした後、2つの半反応式を合体させることで電子が消えます。こうして完成する酸化還元反応の式がイオン反応式です。
イオン反応式で省略されているイオンを加える
ただイオン反応式の場合、省略されているイオンが存在します。例えばMnO4–というのは、実際には過マンガン酸カリウム(KMnO4)です。またH+というのは、硫酸などの強酸です。そこで、これら省略されている陽イオンと陰イオンを加えましょう。
つまり、MnO4–をKMnO4へ変換します。また酸として硫酸を使う場合、6H+を3H2SO4に変えましょう。そうすると、以下のようになります。
- 2KMnO4 + 5(COOH)2 + 3H2SO4 → 2MnSO4 + 10CO2 + 8H2O + K2SO4
H2SO4はK+またはMn2+とイオン結合を形成します。そのため、上記のような酸化還元反応の式になります。
答えを確認すると、酸化還元反応の式は複雑であるとわかります。ヒントなしで酸化還元反応の式を作るのは難しいです。そこで酸化剤と還元剤について反応化合物と生成化合物を覚え、ここまで解説した方法によって酸化還元反応の式を作るようにしましょう。
なお硫酸ではなく、「利用する酸は塩酸や硝酸でも問題ないのでは?」と考える人は多いです。ただ塩酸を利用する場合、Cl–が還元剤として働きます。また、硝酸は酸化剤として働きます。そのため一つの反応ではなく、複数の反応が起こるようになり、実験によって正確な値を得ることができません。
こうした理由があるため、水溶液を酸性にしたい場合、酸化剤にも還元剤にもならず、H+を提供する働きのみを有する硫酸が一般的に利用されます。
酸化還元滴定によって溶液中の化合物量を得る
中和反応と同じように、酸化還元反応を利用した滴定が存在します。これを酸化還元滴定といいます。酸化還元滴定でひんぱんに利用されるのが過マンガン酸カリウムです。
過マンガン酸カリウムは紫色をしています。ただ酸化剤である過マンガン酸カリウムが還元され、酸性条件下でMn2+になると、無色になります。
溶液中に還元剤が存在する場合、過マンガン酸カリウム(酸化剤)と還元剤が反応し、Mn2+(無色)が生成されます。一方で溶液中の還元剤がすべて消失した場合、溶液は過マンガン酸カリウムによって紫色になります。そのため指示薬を利用しなくても、過マンガン酸カリウムを利用すれば酸化還元滴定での終了時点がわかります。
酸化還元滴定が行われる場面としては、例えばCOD(化学的酸素要求量)の測定があります。CODは水中に存在する有機物の量を酸素量に換算して表す指標です。つまりCODの値が高いと、水が汚れていることを意味しています。
過マンガン酸カリウムは有機物を酸化する働きがあります。そのため、過マンガン酸カリウムを利用して酸化還元滴定をすることにより、水中のCOD濃度を求めることができるのです。CODの測定は一つの例ですが、酸化還元反応を利用することによって、さまざまな調査をすることができます。
酸化還元滴定での計算を行う
それでは、実際に酸化還元滴定の計算をしてみましょう。例として、ここまで解説した過マンガン酸カリウムとシュウ酸の反応を利用します。以下の答えは何でしょうか。
- 濃度不明のシュウ酸水溶液が25mLあります。ここに硫酸が加わっている過マンガン酸カリウム水溶液0.1mol/Lを滴下しました。そうすると、20mLを加えた時点で溶液が紫色になりました。シュウ酸水溶液の濃度(mol/L)はいくらでしょうか。
過マンガン酸カリウムとシュウ酸の酸化還元反応は以下になります。
- 2KMnO4 + 5(COOH)2 + 3H2SO4 → 2MnSO4 + 10CO2 + 8H2O + K2SO4
つまり過マンガン酸カリウムとシュウ酸は2:5の割合で反応することがわかります。例えば2molの過マンガン酸カリウムを消費したのであれば、5molのシュウ酸が存在することになります。そのため過マンガン酸カリウムのモル濃度を計算した後、\(\displaystyle\frac{5}{2}\)をかけることでシュウ酸水溶液のモル濃度を得ることができます。
シュウ酸のモル濃度を\(x\)とすると、以下の計算式になります。
\(0.1×\displaystyle\frac{20}{1000}×\displaystyle\frac{5}{2}=x×\displaystyle\frac{25}{1000}\)
\(x=0.2\)
前述の通り、過マンガン酸カリウムとシュウ酸は2:5の割合で反応します。そのため左辺と右辺をイコールでつなぐ(同じ値にする)ためには、左辺を\(\displaystyle\frac{5}{2}\)倍しなければいけません。
または、比例式を利用して計算してもいいです。「過マンガン酸カリウムの物質量:シュウ酸の物質量=2:5」になるため、以下の式を作るのです。
\(0.1×\displaystyle\frac{20}{1000}:x×\displaystyle\frac{25}{1000}=2:5\)
この式を解く場合であっても、\(x=0.2\)mol/Lとなります。いずれにしても、このようにしてシュウ酸の濃度を計算することができました。
酸化還元反応の式を作り、酸化還元滴定の計算を行う
化学反応式を作るとき、酸化還元反応の式は複雑です。酸化還元反応の式を作るときは複数のステップがあります。
ただ、酸化還元反応の式の作り方は決まっています。酸化剤と還元剤の半反応式を最初に作りましょう。反応物と生成物を記載し、H2OとH+とe–を加えるのです。その後、2つの半反応式を合体させることによって酸化還元反応の式を作れるようになります。
また酸化還元反応の式を利用することにより、酸化還元滴定の計算を行えるようになります。物質量をイコールでつなぐとき、反応割合に注意して計算しましょう。
酸化還元反応は中和反応に比べて内容が難しいです。そこで、どのように酸化還元反応の式を作り、酸化還元滴定での計算をすればいいのか理解しましょう。






