高校化学で学ぶ内容の一つがアミノ酸やペプチド、タンパク質です。有機化学や生化学では、これらの分野が重要になります。
タンパク質は私たちにとって必須となる栄養素です。またタンパク質を分解するとペプチドとなり、ペプチドを分解するとアミノ酸になります。つまり、アミノ酸の重合体(ポリマー)がタンパク質です。タンパク質はアミノ酸の高分子化合物なのです。
アミノ酸には酸と塩基の両方の性質があり、光学異性体など独自の化学的特徴があります。生物ではなく化学でアミノ酸やタンパク質を学ぶ理由として、独自の化学的性質があるからです。
それでは、アミノ酸やペプチド、タンパク質にはどのような特徴があるのでしょうか。有機化学・生化学で重要なアミノ酸の性質を確認しましょう。
もくじ
アミノ酸の構造:中性アミノ酸、酸性アミノ酸、塩基性アミノ酸
高校化学で学ぶ天然高分子化合物がタンパク質です。肉にはタンパク質が多く含まれており、タンパク質は栄養素として重要です。
タンパク質はアミノ酸で構成されています。つまりアミノ酸は単量体(モノマー)であり、タンパク質は重合体(ポリマー)です。アミノ酸が重合することでいくつも連なるとタンパク質になるのです。そのため私たちの筋肉(タンパク質)を分解すると、最終的にアミノ酸となります。
アミノ酸の構造は以下のようになっています。
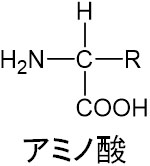
この構造をα-アミノ酸と呼びます。有機化学や生化学で「α-アミノ酸」という言葉がある場合、この構造をもつ化合物を意味しています。なおここでは、α-アミノ酸のことをアミノ酸と記します。
アミノ酸の種類によってR(アルキル鎖)が異なります。例えばR=Hであればグリシンであり、R=CH3であればアラニンです。アミノ酸は複数の種類があり、置換基Rが変化することによってアミノ酸の種類も変わります。
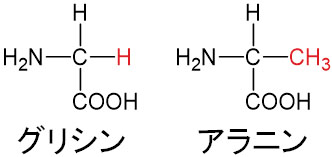
グリシンやアラニンは中性アミノ酸です。RがHやCH3の場合、酸性アミノ酸でも塩基性アミノ酸でもありません。
ただアミノ酸によっては、Rにカルボン酸を含むケースがあります。この場合、酸性アミノ酸と呼ばれます。またアミノ酸によっては、Rにアミノ基を含むケースがあります。この場合、塩基性アミノ酸と呼ばれます。
中性アミノ酸、酸性アミノ酸、塩基性アミノ酸の構造式を確認すると以下のようになります。
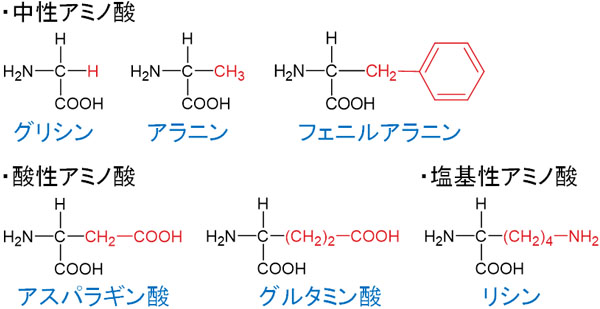
中性アミノ酸、酸性アミノ酸、塩基性アミノ酸の見分け方は簡単であり、Rに酸性官能基または塩基性官能基が含まれているかどうかを確認しましょう。
アミノ酸は双性イオン(両性イオン)であり、等電点をもつ
アミノ酸の特徴に双性イオン(両性イオン)があります。アミノ酸の構造を確認すればわかる通り、すべてのアミノ酸でカルボン酸とアミノ基があります。
カルボン酸は酸性であり、アミノ基は塩基性です。そのため、アミノ酸はプラスの電荷をもつ性質とマイナスの電荷をもつ性質があるのです。中性条件では、中性アミノ酸は以下の平衡状態になっています。
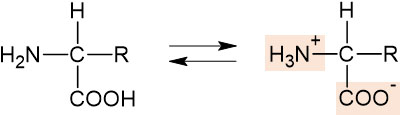
酸性の場合、水溶液には多くのH+が存在することになります。そのため、アミノ酸は陽イオンになります。また塩基性の場合、水溶液には多くのOH–が存在するため、アミノ酸は陰イオンになります。

双性イオン(両性イオン)では、水溶液が酸性なのか塩基性なのかによって分子の形が変わります。
なお、アミノ酸には等電点があります。分子全体の電荷が0になるpHを等電点といいます。双性イオン(両性イオン)であるため、アミノ酸の性質では等電点が重要になります。
中性イオンの場合、等電点は中性付近に存在します。一方でアスパラギン酸やグルタミン酸などの酸性アミノ酸では、等電点は酸性側にあります。また、リシン(塩基性アミノ酸)の等電点は塩基性側にあります。
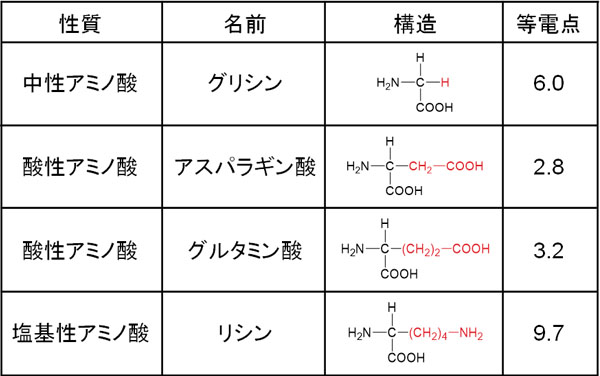
酸性アミノ酸では等電点が酸性側になり、塩基性アミノ酸では等電点が塩基性側になるのは容易に理解できます。
それでは酸性アミノ酸や塩基性アミノ酸では、分子の状態は等電点でどのようになっているのでしょうか。アスパラギン酸とリシンについて、等電点では以下のようになっています。
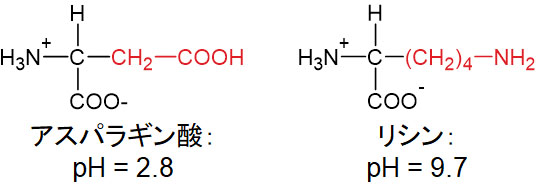
アスパラギン酸でもリシンでも、等電点ではプラスとマイナスの電荷が等しくなります。
多くのアミノ酸は光学異性体
アミノ酸の性質を学ぶとき、ほかにも重要な性質があります。それは、多くのアミノ酸は光学異性体であることです。一つの炭素原子に4つの異なる置換基が結合している場合、必ず光学異性体となります。
グリシンの場合、R=Hであるため、一つの炭素原子に2つのHが結合しています。そのため不斉炭素原子は存在せず、光学異性体ではありません。
一方でアラニンでは、R=CH3です。つまりアラニンでは、炭素原子に結合している置換基はH、CH3、COOH、NH2です。アラニンは不斉炭素原子があるため、光学異性体となります。
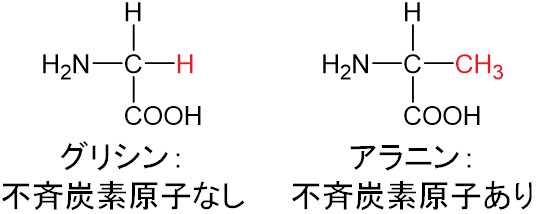
アミノ酸で光学異性体をもたないのはグリシンのみです。グリシン以外のアミノ酸には、すべて光学異性体があります。
構造式は同じであっても、光学異性体では立体が異なります。そのためアミノ酸では、立体を考慮して考えなければいけません。
カルボン酸とアミノ基の反応:エステル化と無水酢酸によるアミド結合
それでは、アミノ酸を利用する合成反応にはどのような種類があるのでしょうか。有機化学や生化学では化合物の反応を学ぶ必要があるため、アミノ酸を利用するときに可能な合成反応を確認しましょう。
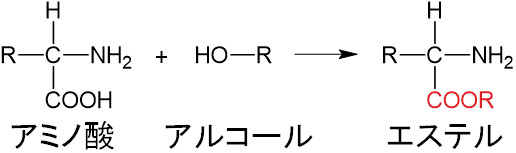
・カルボン酸とアルコールが反応し、エステル結合を作る
アミノ酸はカルボン酸を有しています。カルボン酸はアルコールと反応し、縮合反応を起こすことによってエステル化することが知られています。そのためアミノ酸をアルコールと反応させるとエステル化することができます。
・アミノ基と無水酢酸が反応し、アミド結合を生じる
カルボン酸は無水酢酸と反応しないものの、アミノ基は無水酢酸と素早く反応することでアセチル化され、アミド結合を作ります。
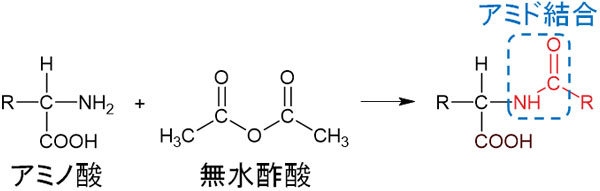
無水酢酸はアルコールやアミノ基と反応し、アセチル化することで知られています。そのため、アミノ基をもつアミノ酸は無水酢酸と反応するのです。
・ニンヒドリン反応
なお、アミノ酸の検出で非常に重要な反応にニンヒドリン反応があります。アミノ酸が存在するかどうかをニンヒドリン反応によって確認できるのです。
ニンヒドリン水溶液にアミノ酸を加え、加熱すると青紫色になります。これをニンヒドリン反応といいます。アミノ基-NH2が存在する場合、ニンヒドリン反応を示します。なおタンパク質はアミノ酸で構成されているため、タンパク質もニンヒドリン反応を示します。
カルボン酸とアミノ酸が脱水縮合し、アミノ酸はペプチドとなる
タンパク質はアミノ酸がたくさん連なることによって構成されていると解説しました。それではアミノ酸同士が結合するとき、どのように結合しているのでしょうか。これを理解するため、ペプチドを学びましょう。
複数のアミノ酸が結合している場合、ペプチドと呼ばれます。アミノ酸が2~50ほど結合している物質がペプチドです。なお、アミノ酸がより多く結合している場合はタンパク質と呼ばれます。多くの場合、タンパク質では数千から数万のアミノ酸が連なっています。
2つのアミノ酸が結合するとき、カルボン酸-COOHとアミノ基-NH2が縮合します。カルボン酸とアミノ基が結合するとアミド結合となります。
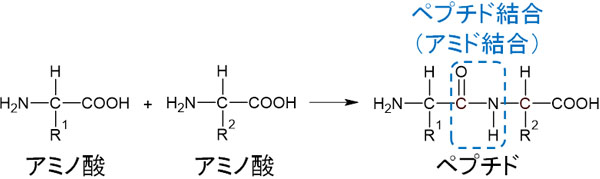
アミド結合の中でも、アミノ酸同士の結合をペプチド結合といいます。ペプチド結合はアミド結合でもあるのです。
縮合反応により、アミノ酸が2つ結合するとジペプチドになります。また、アミノ酸が3つ結合するとトリペプチドになります。多数のアミノ酸が結合している場合、ポリペプチドと呼ばれます。
ポリペプチドの中でも、非常に多くのアミノ酸が連なっている場合はタンパク質となります。タンパク質はポリペプチドの一種なのです。
タンパク質の構造:α-ヘリックスとβ-シート
アミノ酸とペプチドの性質を理解した後、タンパク質の化学的性質を学びましょう。アミノ酸には一次構造、二次構造、三次構造、四次構造があります。
タンパク質となるとき、アミノ酸が順に連なる必要があります。アミノ酸の順番を一次構造といいます。

最も単純な構造が一次構造です。
ただ実際のタンパク質では、鎖状構造となっていることはありません。ペプチド結合(アミド結合)にはC=OやNHが存在するため、タンパク質内に存在するアミノ酸同士が水素結合を作ります。その結果、タンパク質は以下の2つの構造を取ります。
- α-ヘリックス(らせん構造)
- β-シート
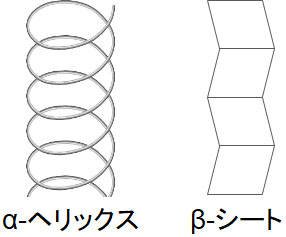
アミノ酸が連なるとき、α-ヘリックス(らせん構造)またはβ-シートとなります。α-ヘリックスはらせん構造をしており、β-シートはジグザグの形をしています。アミノ酸はこのような立体的な構造を取り、これを二次構造といいます。
こうしてα-ヘリックスとβ-シートによる構造をもつたんぱく質は、同じタンパク質内の遠くにあるアミノ酸と水素結合やS-S結合(ジスルフィド結合)、イオン結合を作ります。これにより、ペプチド鎖は複雑に折れ曲がることによって独自の立体構造となります。
例えば、タンパク質は以下のような構造となります。
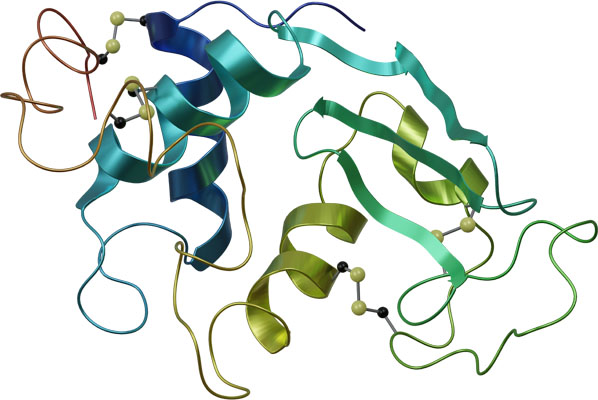
α-ヘリックス(らせん構造)とβ-シートに加え、同じポリペプチド鎖内にて、離れた部分が水素結合やイオン結合などで引き合い、折れ曲がり構造を取ることで独自のタンパク質の形を作ります。これがタンパク質の三次構造です。
なお一つのポリペプチド鎖ではなく、複数のポリペプチド鎖が重なり合うことでタンパク質が機能することがあります。三次構造をもつポリペプチド鎖が複数組み合わさった構造を四次構造といいます。
例えばヘモグロビンは4つのタンパク質が重なり合うことによって、四次構造となっていることが知られています。
タンパク質の分類:単純タンパク質、複合タンパク質、球状タンパク質、繊維状タンパク質
なおタンパク質には多くの種類があります。その中でも、代表的なタンパク質を確認していきましょう。
タンパク質で最初に考えるべき分類が単純タンパク質と複合タンパク質です。単純タンパク質では、タンパク質を加水分解するときにα-アミノ酸のみを生じます。アルブミンやケラチン、コラーゲンなどが単純タンパク質に該当します。
一方、複合タンパク質ではタンパク質を分解することでα-アミノ酸以外の物質を得られます。例えば糖タンパク質を分解する場合、アミノ酸と糖を得られます。リンタンパク質を分解する場合、リンとタンパク質を得られます。
単純タンパク質と複合タンパク質を分類すると以下のようになります。
| 分類 | 名前 | 例 |
| 単純タンパク質 | アルブミン:球状 | 卵白、血清アルブミン |
| グロブリン:球状 | 卵白、血清アルブミン | |
| グルテリン:球状 | 米、小麦 | |
| ケラチン:繊維状 | 毛髪、爪 | |
| コラーゲン:繊維状 | 皮膚、軟骨 | |
| フィブロイン:繊維状 | 絹糸 | |
| 複合タンパク質 | 糖タンパク質 | ムチン(唾液) |
| リンタンパク質 | カゼイン(牛乳、チーズ) | |
| 色素タンパク質 | ヘモグロビン、クロロフィル | |
| 核タンパク質 | 核酸(DNA、RNA)、染色体 |
なお単純タンパク質はさらに球状タンパク質と繊維状タンパク質に分かれます。
球状タンパク質には、血しょうの成分であるアルブミンやグロブリンが含まれます。血しょうの成分であることから想像できる通り、球状タンパク質は体内で生命維持に関与しているケースが多いです。また水に溶けるのも球状タンパク質の特徴です。
一方、皮膚や毛髪、軟骨など生体組織を担っているのが繊維状タンパク質です。絹糸(シルク)も繊維状タンパク質であり、繊維状タンパク質は強くて切断されにくく、水に溶けません。ポリペプチド鎖が束になっているタンパク質が繊維状タンパク質です。
変性と塩析がタンパク質で重要な性質
それでは、タンパク質で重要な性質には何があるのでしょうか。化学で覚えなければいけないタンパク質の特徴は以下の2つです。
- 変性
- 塩析
小さい分子の場合、熱を加えたり酸・塩基を加えたりしても、化学反応を起こさない限りは特に変化はありません。一方でタンパク質の場合、先に述べた通りアミノ酸の配列だけでなく、三次構造(立体構造)が重要になります。立体構造が崩れると、元の機能を発揮することができません。
そのためタンパク質に対して熱や酸、塩基、重金属を加えると、タンパク質の立体構造が崩れて凝固します。これを変性と呼び、凝固した後のタンパク質は元に戻ることができません。
例えば、卵の大部分はタンパク質で構成されています。生卵を加熱するとタンパク質が凝固し、固まります。

このとき、加熱後の卵を生卵に戻すことはできません。これは、タンパク質が変性したら元に戻らないからです。
・球状タンパク質が水に溶けるのはコロイドになるから:タンパク質と塩析
タンパク質でもう一つ重要な性質が塩析です。塩析を理解するため、タンパク質とコロイドの関係を理解しましょう。
通常、タンパク質は水に溶けません。ただ球状タンパク質の場合、前述の通り水に溶けます。本来であれば水に溶けないタンパク質が水に溶けるとは、どういう意味なのでしょうか。
タンパク質が水に溶けるというのは、より正確にいうとタンパク質がコロイドになって均一に分散している状態を指します。そのため厳密には、球状タンパク質は水に溶けてはいけません。
コロイド粒子は小さく、通常では水に溶けない物質であっても、コロイドとして水中へ均一に分散することによって水に溶けているときと同じようにふるまうことができます。タンパク質についても、コロイドとして存在する場合は水中を漂うことができるのです。
またタンパク質はアミノ酸で構成されており、水素結合やイオン結合など、さまざまな結合を作ります。そのため、タンパク質は水との親和性が強いです。こうしたコロイドを親水コロイドといいます。
親水コロイドの場合、多少の電解質を加えても沈殿しません。ただ大量の電解質を加える場合、電解質はコロイドがもつ電荷を打ち消し、水と親水コロイドとの親和性が失われ、沈殿を生じさせます。この現象を塩析といいます。
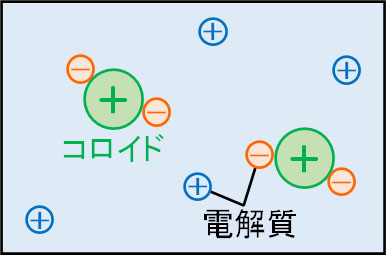
化学でコロイドを学ぶとき、必ず親水コロイドや塩析を学びます。タンパク質は親水コロイドであるため、塩析を生じるのです。
タンパク質の検出法:ニンヒドリン反応、ビウレット反応、キサントプロテイン反応
次に、タンパク質の検出法を学びましょう。タンパク質が存在するかどうかについて、調べる方法があるのです。
重要なタンパク質の検出方法には以下があります。
- ニンヒドリン反応
- ビウレット反応
- キサントプロテイン反応
- 硫黄の検出反応
- 窒素の検出反応
それぞれの方法を確認していきましょう。
・ニンヒドリン反応
手軽にタンパク質の存在を検出する方法としてニンヒドリン反応があります。ニンヒドリン反応は先ほど解説しました。アミノ基-NH2を有する化合物ではニンヒドリン反応を起こします。タンパク質はアミノ酸で構成されているため、ニンヒドリン反応を示すのです。
ニンヒドリン溶液にタンパク質を加え、加熱するとアミノ酸と同様に青紫色となります。
・ビウレット反応
トリペプチド以上(ペプチド結合が2つ以上あるペプチド)では、ビウレット反応によって検出できます。
ビウレット反応では、水酸化ナトリウム水溶液によって塩基性にした後、硫酸銅(Ⅱ)CuSO4水溶液を加えます。そうすると、無色から赤紫色へと変化します。
・キサントプロテイン反応
ベンゼン環をもつアミノ酸(フェニルアラニン、チロシン)、またはタンパク質を検出するときにキサントプロテイン反応が利用されます。タンパク質は何千、何万ものアミノ酸が連なっているため、タンパク質は一部にフェニルアラニンやチロシンをもつアミノ酸を含むというわけです。
キサントプロテイン反応では、濃硝酸を加えて加熱します。そうすると、ベンゼン環がニトロ化されて黄色になります。ベンゼン環に濃硝酸を加えて加熱する場合、置換反応が起こってニトロ化することは既に学んでいると思います。

ニトロ化合物は多くのケースで黄色であるため、キサントプロテイン反応によって黄色へ変化します。なお冷却後、アンモニア水などを加えることで溶液を塩基性にすると橙黄色になります。
・硫黄の検出反応
システインやメチオニンは構造内に硫黄Sを含みます。硫黄を含むアミノ酸を検出するとき、またはタンパク質の検出をするとき、酢酸鉛(Ⅱ)を利用します。
水酸化ナトリウム水溶液を加えて加熱した後、酢酸鉛(Ⅱ)(CH3COO)2Pb水溶液を加えます。これにより、タンパク質に存在する硫黄Sと鉛Pbが反応し、硫化鉛PbSによる黒色沈殿を生じます。
・窒素の検出反応
タンパク質に含まれる窒素Nを検出することにより、タンパク質が存在するかどうかを判定する方法があります。
水酸化ナトリウム水溶液を加えて加熱すると、タンパク質が存在する場合はアンモニアNH3が発生します。アンモニアは塩基性であるため、赤色のリトマス紙を青色に変えます。
これらがタンパク質の検出方法です。種類は多いものの、これらの方法を利用することによってタンパク質が存在するかどうかを確認できます。
アミノ酸、ペプチド、タンパク質の性質を学ぶ
有機化学や高分子化学、生化学で重要な分野がアミノ酸です。アミノ酸が複数連なることでペプチドとなり、多数のアミノ酸が連なることによってタンパク質となります。
アミノ酸は不可欠な栄養素であるため、化学では必ずアミノ酸の性質を学びます。アミノ酸の重要な化学的性質としては、双性イオン(両性イオン)であることです。また、ほとんどのアミノ酸は光学異性体です。
なおペプチド結合(アミド結合)によってα-アミノ酸がつながると、ペプチドと呼ばれます。アミノ酸はエステル化やアセチル化などの反応を起こすものの、ペプチドではアミド結合を作る必要があります。
また、多くのアミノ酸が連なるとタンパク質となり、一次構造だけでなく二次構造や三次構造、四次構造と独自の立体構造を取ります。特にα-ヘリックスやβ-シートは重要な構造なので必ず覚えましょう。なお変性や塩析など、タンパク質独自の特徴も理解する必要があります。
アミノ酸やタンパク質は重要な栄養素であるため、覚えなければいけないことは多いです。そこで、それぞれの内容を整理して化学的性質を理解しましょう。