無機化学を学ぶとき、さまざまな種類の気体の発生方法を習います。これらをすべて暗記するのは大変ですし、現実的ではありません。そこで、反応の種類に着目しましょう。
化学反応には酸化還元反応や脱水反応、弱酸の遊離など、さまざまな種類があります。どの反応に該当するのかによって、得られる分子がわかります。
また気体を発生させるとき、適切な装置を利用しなければいけません。そこで、どのような装置を利用すればいいのか理解しましょう。また気体を集める方法は3種類あるため、どの方法が最適なのか気体ごとに把握しましょう。
気体の製法は種類が多く、無機化学を学ぶときに多くの人が混乱します。そこでどのように気体の製法を整理し、覚えればいいのか解説していきます。
もくじ
気体の製法では特徴を覚える
無機化学を学ぶとき、戦略なしに暗記するのは非常に効率が悪いです。そこで、なぜその反応が起こるのか整理しましょう。以下に主な気体の製法を記します。
・H2の生成:イオン化傾向を用いた酸化還元反応
亜鉛に希硫酸などの強酸を加えると水素H2が発生します。
- Zn + H2SO4 → ZnSO4 + H2
亜鉛は水素よりもイオン化傾向が強いです。つまり積極的にイオンになりたいと亜鉛は考えています。そこで亜鉛はイオンになり、水溶液中に存在する水素イオンがH2として生成されます。
・O2の生成:分解反応
酸素O2を発生させるとき、二つの方法があります。一つは過酸化水素に二酸化マンガン(触媒)を入れる方法です。
- 2H2O2 → 2H2O + O2
二酸化マンガン(触媒)によって過酸化水素が分解し、酸素が発生します。また、塩素酸カリウム(KClO3)に二酸化マンガン(触媒)を加え、加熱することによっても酸素を得ることができます。
- 2KClO3 → 2KCl + 3O2
塩素酸カリウム(KClO3)を用いる方法についても、分解反応によって酸素が発生します。
・O3の生成:O2から発生する
オゾンO3の製法は特殊であり、空気中に存在する酸素に紫外線が当たる、または空気中で無声放電をすることによってオゾンを発生させることができます。
- 3O2 → 2O3
・N2の生成:分解反応
亜硝酸アンモニウムを加熱すると、分解反応を起こして窒素N2を得ることができます。
- NH4NO2 → 2H2O + N2
・Cl2の生成:酸化還元反応
塩素Cl2は強力な酸化剤であるため、酸化還元反応を利用してCl2を作ります。二酸化マンガンは酸化剤として知られており、濃塩酸(HCl)を加えて熱することでCl2を得ることができます。
- MnO2 + 4HCl → MnCl2 + 2H2O + Cl2
なおCl2を得るとき、以下の装置を利用します。
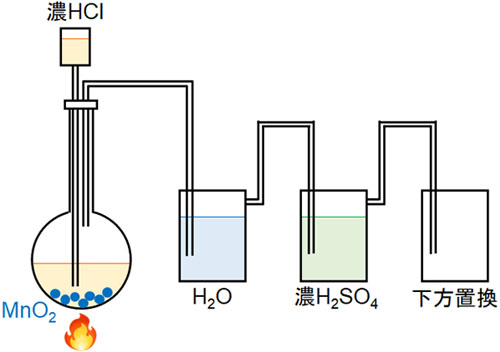
発生した気体にはCl2だけでなくHClが混ざっているため、H2Oを用いてHClを除去します。次に濃H2SO4を利用してH2Oを除去します。こうして、Cl2を得ることができます。
なおCl2を発生させるとき、さらし粉に希塩酸を加えることによっても可能です。この場合、化学反応式は以下のようになります。
- CaCl(ClO)·H2O + 2HCl → CaCl2 + 2H2O + Cl2
・フッ化水素の生成:揮発性酸の遊離
硫酸は不揮発性の酸です。そこで濃硫酸を加えて加熱すると、不揮発性の硫酸は残り、揮発性の酸は蒸発します。この方法を利用する化学反応を揮発性酸の遊離反応といいます。
フッ化カルシウム(CaF2:ホタル石)に濃硫酸を加え、加熱するとフッ化水素HFを得ることができます。
- CaF2 + H2SO4 → CaSO4 + 2HF
硫酸は蒸発しないため残るものの、フッ化水素は揮発性があるため、加熱によってHFを得られます。
・塩化水素の生成:揮発性酸の遊離
同じく揮発性酸の遊離反応を利用することにより、塩化水素HClを得ることができます。塩化ナトリウムに濃硫酸を加え、加熱します。そうすると硫酸は残り、揮発性の気体である塩化水素を得ることができます。
- NaCl + H2SO4 → HCl + NaHSO4
NaClとH2SO4を混ぜる場合、NaCl、NaHSO4、HCl、H2SO4が生成する可能性があります。このうち、揮発性物質なのはHClのみです。そのため加熱することでHClのみが蒸発し、塩化水素を得ることができるのです。
・一酸化炭素の生成:濃硫酸による脱水
濃硫酸には脱水作用があり、ほかの分子に存在するH2Oを引き抜く働きがあります。そのためギ酸(HCOOH)に濃硫酸を加え、加熱するとギ酸の分子内からH2Oがなくなり、一酸化炭素COが生成されます。
- HCOOH → H2O + CO
・二酸化炭素の生成:弱酸の遊離
石灰石(炭酸カルシウム:CaCO3)に塩酸を加えると、二酸化炭素CO2が発生します。
- CaCO3 + 2HCl → CaCl2 + H2O + CO2
CO32-の元となる炭酸H2CO3は弱酸です。そのため強酸を加えると、強塩基由来のCa2+と強酸由来のCl–が結合して炭酸(弱酸)が遊離します。なお炭酸は水(H2O)と二酸化炭素(CO2)に分解されるため、結果として二酸化炭素を得ることができます。
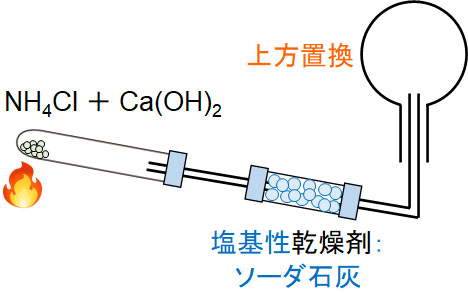
・アンモニアの生成:弱塩基の遊離
強塩基を加えることによって、弱塩基を遊離させることができます。この方法を利用してアンモニアNH3を生成することができます。塩化アンモニウムと水酸化カルシウムを混ぜると、アンモニアが発生します。
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3
強酸由来のCl–と強塩基由来のCa2+が結合します。その結果、弱塩基であるアンモニアが生成されるのです。
・一酸化窒素の生成:希硝酸を用いた酸化還元反応
イオン化傾向の高い金属に酸を加えると水素を発生します。一方、銅(Cu)のようにイオン化傾向が水素よりも低い場合、強酸を加えても水素は発生しません。
ただ硝酸のように、酸化力のある酸を加えると酸化還元反応が起こって銅は溶け、気体が発生します。希硝酸を利用する場合、発生する気体は水素ではなく一酸化窒素NOになります。
- 3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
・二酸化窒素の生成:濃硝酸を用いた酸化還元反応
先ほどは希硝酸を利用しました。一方、濃硝酸を用いる場合は二酸化窒素NO2が生成されます。
- Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
・二酸化硫黄の生成:熱濃硫酸を用いた酸化還元反応
先ほどは希硝酸、または濃硝酸を用いた酸化還元反応(イオン化傾向を利用した反応)を解説しました。このとき利用する酸化剤を熱濃硫酸にすると、二酸化硫黄SO2が発生します。
- Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
濃硫酸を加熱すると酸化剤として働くようになります。希硝酸や濃硝酸は過熱しなくても酸化作用をもつものの、濃硫酸に酸化作用をもたせるためには熱する必要があります。
・硫化水素の生成:弱酸の遊離
硫化鉄(Ⅱ)に希硫酸(または希塩酸)を加えると硫化水素H2Sを得ることができます。塩酸や硫酸は強酸であるため、弱酸の遊離によって硫化水素が生成されます。
- FeS + H2SO4 → FeSO4 + H2S
加熱の有無はどのように見分けるのか
これらの化学反応について、加熱の有無はどのように見分ければいいのでしょうか。目安としては、以下のケースでは過熱する場合がほとんどです。
- 固体同士の反応
- 濃硫酸を用いる反応
固体同士を反応させるには、熱を加えることで反応を促進させなければいけません。固体の場合、液体のように分子は自由に動けません。そのため、加熱が必要になります。
また、濃硫酸を熱すると「揮発性酸の遊離反応を起こすようになる」「脱水作用によって相手分子のH2Oを取り除く」「熱濃硫酸として酸化作用を発揮する」などの働きをするようになります。
気体の乾燥剤を使い分ける
また先ほどの化学反応式を確認すると、反応によってはH2Oも発生するケースがあります。この場合、水を取り除くことによって気体にH2Oが含まれていない状態にするのが一般的です。そのために乾燥剤が使われます。
乾燥剤には酸性、中性、塩基性があります。そのため、最適な乾燥剤を選びましょう。例えば発生させる気体が酸性の場合、塩基性乾燥剤は適しません。同様に、発生させる気体が塩基性の場合、酸性乾燥剤は適しません。
なお中性の乾燥剤については、ほとんどのケースで利用できます。乾燥剤には以下の種類があります。
| 乾燥剤 | 性質 |
| 十酸化四リン:P4O10 | 酸性 |
| 濃硫酸:H2SO4 | 酸性 |
| 塩化カルシウム:CaCl2 | 中性 |
| シリカゲル:SiO2·nH2O | 中性 |
| 酸化カルシウム:CaO | 塩基性 |
| ソーダ石灰:CaO + NaOH | 塩基性 |
基本的には、酸性の気体に酸性乾燥剤を利用すれば問題ありません。ただ例外があり、硫化水素(H2S)の乾燥で濃硫酸は利用できません。硫化水素は還元剤であり、濃硫酸は酸化剤です。中和反応は起こさないものの、酸化還元反応を起こすため、硫化水素の乾燥に濃硫酸を利用するのは不適です。
他にも例外があり、それがアンモニアと塩化カルシウムです。塩化カルシウムは中性の乾燥剤であるため、ほとんどの気体の乾燥に有効です。ただ塩化カルシウムはNH3と反応することでCaCl2·8NH3となります。そのため、アンモニアの乾燥に塩化カルシウムは不適です。
気体の発生装置:ふたまた試験管やキップの装置
なお実際に気体を発生させるとき、最適な装置を組まなければいけません。それでは、どのような発生装置を利用すればいいのでしょうか。
・固体と液体、または液体同士の反応(加熱なし):三角フラスコ、ふたまた試験管、キップの装置
まず、加熱しない場合は三角フラスコやふたまた試験管、キップの装置を利用します。
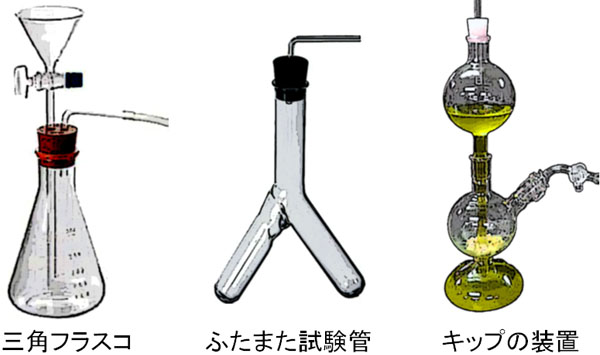
三角フラスコは最も単純な気体発生装置の一つです。反応させたい物質を加えることにより、気体が出てきます。
ただ三角フラスコを利用する場合、反応を途中で止めることができません。固体と液体を反応させるとき、途中で反応を止めたいときはふたまた試験管を利用します。ふたまた試験管では、以下の部分に突起があります。
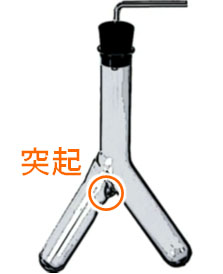
そのため固体を突起に引っ掛けることにより、固体の移動を止めることができます。一方、液体はふたまた試験管の反対側に移動させることができます。こうして固体と液体を分けることにより、途中で反応をストップさせることができます。
なおふたまた試験管を進化させた装置がキップの装置です。加熱を必要としない気体の発生について、活栓の開け閉めによって気体を発生させたり、反応を止めたりすることができます。
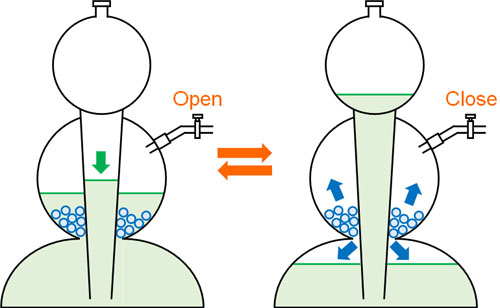
活栓を開けると、重力によって液体が下に落ち、固体と反応することで気体を発生させることができます。一方、活栓を閉めると発生した気体によって液体が押し上げられ、固体と液体が触れなくなって気体の発生が止まります。これがキップの装置の原理です。
・固体と液体、または液体同士の反応(加熱あり):試験管、丸底フラスコ
それでは、加熱する場合はどのような装置を利用すればいいのでしょうか。この場合、試験管または丸底フラスコを利用しましょう。
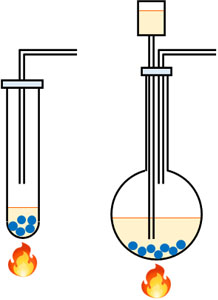
試験管と丸底フラスコに共通しているのは、両方とも底が丸であることです。これにより、加熱してもガラスが割れることなく液体を加熱できます。
・固体と固体を発生させる:試験管
固体と固体を反応させるとき、必ず加熱します。このときは試験管を利用し、試験管の底を少し高くします。これにより、反応によって水などの液体が発生しても、液体が試験管の底にたまることがなくなります。

どのような化合物を反応させるのかによって、最適な実験装置を組み立てられるようになりましょう。
気体の捕集法:上方置換、下方置換、水上置換
次に、発生させた気体の集め方を学びましょう。気体を集めるとき、以下の3種類があります。
- 上方置換
- 下方置換
- 水上置換
水に溶けやすく、空気よりも軽い気体を集めたいとき、上方置換を利用します。発生させた気体が空気より軽い場合、気体は上昇していきます。なお、無機化学の基礎では「上方置換で集める気体=アンモニア」と覚えましょう。以下のように、上方置換でアンモニアを集めます。
次に、水上置換を確認しましょう。水を利用して集めるのが水上置換です。一酸化炭素(CO)、一酸化窒素(NO)、水素(H2)、酸素(O2)、窒素(N2)は水上置換を利用して集めます。
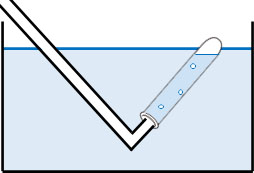
水に溶けにくい物質の場合、水上置換が適しています。特に、一酸化炭素や一酸化窒素は空気と反応して二酸化炭素や二酸化窒素になります。水上置換を利用すれば、発生させた気体が空気に触れるのを防ぐことができます。
上記以外の気体については、下方置換で集めます。水に溶ける性質があり、空気よりも重い気体は下方置換を利用しましょう。例えばNaClと濃硫酸を加えて加熱する場合、前述の通り塩化水素(HCl)が発生します。
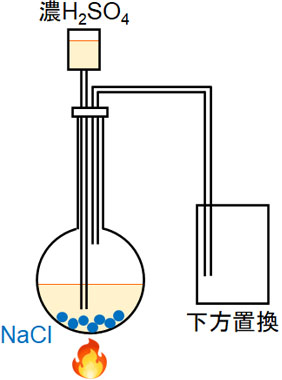
塩化水素は水に溶けやすく、空気よりも重いため、下方置換を利用して集めましょう。
気体の製法と装置の仕組み、気体の集め方を学ぶ
無機化学では多くの種類の気体を学びます。気体によって発生の仕方が異なり、気体の製法を覚えなければいけません。
ただ、一つずつ気体の製法を覚えるのは非効率です。そこで、なぜその気体が発生するのか原理を理解しましょう。例えば揮発性酸の遊離反応であると判断できる場合、どの種類の気体を得ることができるのかわかります。反応の種類を見分ければ、気体の製法を理解しやすくなります。
また気体を発生させるとき、最適な装置を組まなければいけません。そこで気体を発生させるときの装置を理解し、さらには気体の集め方も学びましょう。
無機化学では覚えなければいけないことが多いものの、実際のところ原理を学べば覚えなくてもいいケースが多いです。気体の発生も同様であり、化学反応が起こる原理を理解することで発生する気体を見分けられるようになりましょう。






