有機化学で重要な実験に元素分析があります。化合物の分子式を決定するとき、必ず元素分析をしなければいけません。
化合物の分子式が未知であることはよくあります。また、化合物の分子式がわかっていたとしても、ターゲット化合物を本当に得られているかどうかわかりません。そうしたとき、元素分析をすることで目的化合物を得られたことを証明しなければいけません。
元素分析は古典的な手法であるものの、有機化合物を取り扱う研究では必須の実験です。また有機化学の研究室では、元素分析を行う場面が何度もあります。
それでは、元素分析によってどのように分子量を測定し、分子式を決定すればいいのでしょうか。元素分析の原理や分子式の決定法を解説していきます。
もくじ
組成式と式量:分子に含まれる原子の組成比率
元素分析を学ぶ前に、組成式と式量を理解しましょう。組成式とは、「化合物の構成元素について、最も簡単な比率で表した式」を指します。
例えばグルコース(糖)の分子式はC6H12O6です。炭素6個、水素12個、酸素6個の原子を利用することによってグルコースを形成できます。
それでは、グルコースの組成式は何でしょうか。C6H12O6を最も簡単な整数比で表しましょう。そうすると、CH2Oになります。つまり、CH2Oがグルコースの組成式です。含まれている元素を最も小さい整数比にすれば、組成式を得られます。

組成式を得られたら式量を計算できます。組成式に含まれる原子量の和を式量といいます。
前述の通り、グルコースの組成式はCH2Oです。また原子量を確認すると、「C=12、H=1、O=16」です。そのため、式量は以下のようになります。
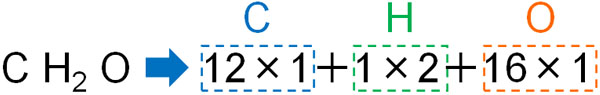
この計算式を解くと、グルコースの式量は30とわかります。組成式に対する原子量が式量と理解しましょう。
元素分析によってH、C、Oの質量と物質量を計算する
それでは、元素分析を行うことでどのように分子式を決定するのでしょうか。まず、元素分析とは何かを理解しましょう。
元素分析では、試料を燃やします。つまり化合物を燃やし、どれだけの量のH2OとCO2が発生したのかを測定します。具体的には、化合物の燃焼によって発生したH2OとCO2の質量を確認します。
なぜH2Oの質量を測定するかというと、分子内にHが存在する場合、燃焼することでO2と反応して水が発生するからです。同様に、分子内にCが存在すると燃焼によってCO2が発生します。つまりH2OとCO2の質量を測定することによって、HとCの物質量がわかります。
また化合物に含まれている元素がHとCとOのみである場合、「燃やした化合物の合計質量」から検出されたHとCの質量を引けば、化合物に含まれるOの質量がわかります。また質量がわかればHやC、Oの物質量もわかります。
元素分析の装置とH、C、Oの質量
それでは、元素分析を行うときの装置を確認しましょう。実際の装置を理解すれば、どのように化合物の質量を計算するのかわかります。
最初に行うのは、化合物の質量を測定することです。化合物の質量を正確に測定し、燃やすのです。O2を流しながら試料を燃やし、H2OとCO2を発生させます。場合によっては不完全燃焼によって一酸化炭素(CO)が生成されることもあるため、酸化銅(Ⅱ)CuOを利用することでCOを酸化し、CO2にします。
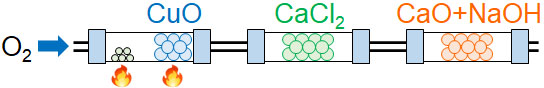
その後、最初に通過するのは塩化カルシウム(CaCl2)を満たした管です。試料を完全燃焼させた後、CaCl2で満たされている管を通過することにより、発生したH2Oが吸収されます。
H2Oが吸収されると、その分だけ質量が重くなります。そこで、試料を燃やす前後でどれだけ質量が重くなったのかを測定します。
次にソーダ石灰(CaO + NaOH)を満たした管に燃焼させた気体を通します。これにより、発生したCO2をソーダ石灰に吸着させることができます。完全燃焼の前後でソーダ石灰の質量がどれだけ重くなったのかを測定することにより、発生したCO2の質量がわかります。
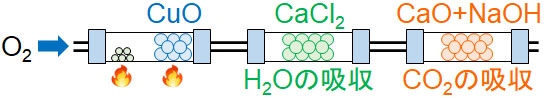
なお、必ず「塩化カルシウム→ソーダ石灰」の順番である必要があります。ソーダ石灰はCO2だけでなく、H2Oも吸収します。そのため順番が逆の場合、正しくH2OとCO2の質量を測定できません。
・試料の質量から、HとCの質量を引く
H2OとCO2の質量がわかれば、測定した化合物に含まれているHとCの質量がわかります。そこで化合物の質量からHとCの質量を引きましょう。そうすれば、化合物に含まれているOの質量がわかります。
- Oの質量 = 化合物の質量 - (Hの質量 + Cの質量)
また質量がわかれば、物質量を計算できます。こうしてHやC、Oの物質量の比がわかります。
物質量の比を求め、組成式を得る
それでは、実際に計算してみましょう。以下の問題の答えは何でしょうか。
- 水素H、炭素C、酸素Oのみで構成される有機化合物2.2mgを完全燃焼させると、1.8mgのH2Oと4.4mgのCO2が発生しました。この有機化合物の組成式は何でしょうか。なお、原子量はH=1、C=12、O=16とします。
まず、それぞれの元素の質量を計算しましょう。H2Oの分子量は18です。それでは、1.8mgのH2Oに含まれるHの質量はいくらでしょうか。H2Oには2つのHが含まれており、Hの原子量は1です。前述の通りH2Oの分子量は18なので、\(\displaystyle\frac{2}{18}\)倍することでHの質量を得られます。
- \(1.8×\displaystyle\frac{2}{18}=0.2\)
Hの質量は0.2mgとわかりました。同じように、Cの質量を計算しましょう。Cの原子量は12であり、CO2の分子量は44です。そのため、\(\displaystyle\frac{12}{44}\)倍によってCの質量を得られます。
- \(4.4×\displaystyle\frac{12}{44}=1.2\)
こうして、Cの質量は1.2mgとわかります。また完全燃焼させた化合物の質量は2.2mgです。構成元素はHとCとOのみなので、HとCの質量を引けば、Oの質量がわかります。
\(2.2-(0.2+1.2)=0.8\)
こうして、Oの質量は0.8mgとわかります。
・物質量の比を出し、組成式を求める
次に物質量を計算しましょう。それぞれの物質量は以下のようになります。
- \(H:\displaystyle\frac{0.2}{1}×\displaystyle\frac{1}{1000}=0.2×10^{-3}\) mol
- \(C:\displaystyle\frac{1.2}{12}×\displaystyle\frac{1}{1000}=0.1×10^{-3}\) mol
- \(O:\displaystyle\frac{0.8}{16}×\displaystyle\frac{1}{1000}=0.05×10^{-3}\) mol
1mgは\(\displaystyle\frac{1}{1000}\)gであるため、物質量の計算では\(\displaystyle\frac{1}{1000}\)倍しています。先ほど計算した物質量の比率を整数比に変換すると、以下のようになります。
- \(H:C:O=\displaystyle\frac{0.2}{1}:\displaystyle\frac{1.2}{12}:\displaystyle\frac{0.8}{16}\)\(=4:2:1\)
こうして、化合物の組成式はC2H4Oとわかります。含まれる原子の数は物質量で比較する必要があるため、質量を出した後、物質量の比を計算しましょう。
分子量を計算し、分子式を求める
組成式がわかったら、次に分子量の計算をしましょう。例えばグルコースの分子式はC6H12O6であり、CH2Oではありません。そこで、分子式を得る必要があります。
問題文によっては、分子量が与えられていることがあります。この場合、計算は簡単です。例えば、CH2Oの式量は前述の通り30です。
- \(12+1×2+16=30\)
それでは分子量が与えられており、例えば180とわかっている場合、分子式はどのようになるでしょうか。式量は30であるため、6倍すれば分子量になるとわかります。そこで組成式を6倍し、C6H12O6にすれば、分子式を得ることができます。
・分子量が与えられていない場合の計算方法
それでは、分子量がわかっていない場合はどのように分子式を決定すればいいのでしょうか。元素分析によって分子式を決定するためには、必ず事前に分子量を知っておく必要があります。
分子量を計算する方法としては主に以下の種類があります。
- 気体の状態方程式を利用する
- 浸透圧を利用する
- 沸点上昇または凝固点降下を利用する
それぞれの公式には分子量が含まれているため、分子量の計算が可能です。
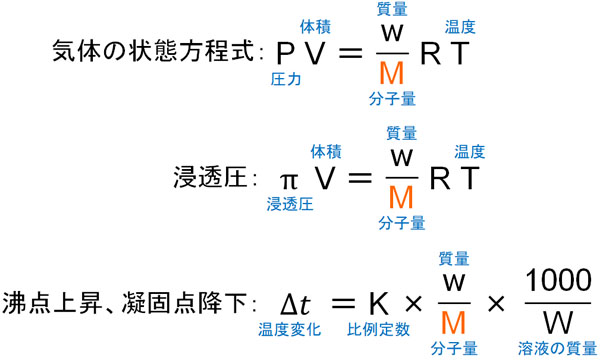
分子量を得ることができたら、式量と比較しましょう。式量を何倍すれば、分子量になるのか計算するのです。その後、組成式を整数倍することによって分子式を決定できます。
元素分析は古典的な方法だがいまでも利用される
化合物の質量を測定する方法に元素分析があります。H2OとCO2を吸収させ、質量の増加を測定することにより、化合物に含まれるHやC、Oの物質量を計算することができます。
元素分析は古典的な実験方法であるものの、いまでもひんぱんに利用されます。未知化合物の構造決定をしたり、ターゲット化合物が生成していると確定したりするとき、必ず元素分析をしなければいけません。
そこで元素分析の原理を理解し、化合物に含まれているHやC、Oの物質量を計算できるようになりましょう。これにより、組成式がわかります。また分子量と組成式を利用して分子式を決定しましょう。
有機化学で学ぶ元素分析は重要です。分子式を決定できるようになるため、元素分析の方法を理解しましょう。






