無機化学でアルカリ土類金属を学びます。アルカリ土類金属で重要なのはカルシウムとバリウムです。アルカリ土類金属を学ぶというのは、カルシウムとバリウムの性質を覚えるのと意味が同じです。
アルカリ土類金属は2族元素です。ただ同じ2族元素であっても、ベリリウムとマグネシウムはアルカリ土類金属ではないことに注意しましょう。
アルカリ土類金属の中でも、特に重要な元素がカルシウムです。カルシウムを含む化合物は多く、さまざまな日常の場面で利用されています。またカルシウムほどではないものの、バリウムも利用される機会が多いです。
それでは、カルシウムとバリウムの性質には何があるのでしょうか。ここでは、アルカリ土類金属の特徴や化合物の性質を解説していきます。
もくじ
ベリリウムとマグネシウム以外はアルカリ土類金属
2族元素には共通点があります。2族元素は2つの価電子をもつため、2つの電子を失うことで2価の陰イオンになります。またイオンになりやすいため、自然界では単体で存在せず、化合物として存在しています。またイオン化傾向が高いため、単体の金属として得るためには融解塩電解を利用します。
2族元素にはこうした共通点があるものの、ベリリウムとマグネシウム以外をアルカリ土類金属に分類します。アルカリ土類金属にはカルシウム(Ca)、ストロンチウム(Sr)、バリウム(Ba)、ラジウム(Ra)があります。元素周期表で以下がアルカリ土類金属になります。
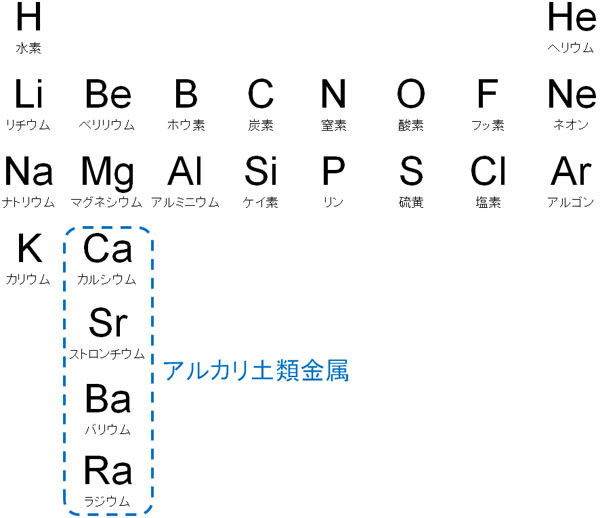
ベリリウムとマグネシウム以外をアルカリ土類金属とする理由は、性質が大きく異なるからです。
また無機化学では、アルカリ土類金属の中でもカルシウムとバリウムが特に重要です。そこで、カルシウムとバリウムの性質を覚えましょう。
アルカリ土類金属の炭酸塩、硫酸塩は水に溶けない
それではアルカリ土類金属と比べて、ベリリウムとマグネシウムはどのように性質が異なるのでしょうか。
アルカリ金属の場合、イオンはどれも水に溶けます。一方、アルカリ土類金属では水に溶けにくいケースがあります。特にアルカリ土類金属がCO32-やSO42-と結合する場合、水に溶けにくい塩を作ります。
そのためCaCO3、CaSO4、BaCO3、BaSO4はどれも水に溶けません。一方、ベリリウムとマグネシウムの場合、硫酸塩(BeSO4、MgSO4)は水に溶けます。
ちなみに、アルカリ土類金属の酸化物(CaO、BaO)などは熱を加えても変化せず、水に難溶であるため、土と性質が似ています。そのため、アルカリ土類金属と呼ばれています。
なおアルカリ土類金属には、ほかにも以下の点が共通しています。
- 単体の金属は水と反応し、水酸化物を生じる
- Ca(OH)2やBa(OH)2などの水酸化物は水に溶ける
- 炎色反応を示す
それに対して、ベリリウムとマグネシウムは反対の性質をもちます。表にすると以下のようになります。
| Be、Mg | アルカリ土類金属(Ca、Ba) | |
| 硫酸塩 | 水に溶ける | 水に溶けない |
| 冷水との反応 | 反応しない | 反応する(H2の発生) |
| 水酸化物 | 水に溶けない | 水に溶ける(強塩基性) |
| 炎色反応 | なし | あり |
こうした違いがあるため、ベリリウムとマグネシウムはアルカリ土類金属に含まれません。
アルカリ土類金属の化合物
それではアルカリ土類金属の中でも、カルシウムとバリウムの性質に着目しましょう。カルシウムとバリウムの中でも、特に重要な化合物は以下になります。
- 炭酸カルシウム:CaCO3
- 酸化カルシウム:CaO
- 水酸化カルシウム:Ca(OH)2
- 硫酸カルシウム:CaSO4
- 硫酸バリウム:BaSO4
バリウムよりも、カルシウムのほうが重要な元素です。そのため無機化学でアルカリ土類金属を学ぶとき、カルシウムを含む化合物を多く学ぶことになります。そこで、それぞれの化合物の特徴を確認していきましょう。
炭酸カルシウムCaCO3:塩酸と反応し、二酸化炭素を生じる
大理石や石灰岩の主成分が炭酸カルシウムです。無機化学で重要な「炭酸カルシウムを利用する反応」は2つです。
一つは塩酸を利用する反応です。炭酸カルシウムに塩酸を加えると、弱酸の遊離によって二酸化炭素が発生します。
- CaCO3 + 2HCl → CaCl2 + H2O + CO2
炭酸は弱酸です。一方、カルシウムは強塩基由来です。そのため強酸を加えることによって、強酸と強塩基に由来する塩ができます。そうして炭酸が生成するものの、炭酸は水と二酸化炭素へすぐに分解され、結果として二酸化炭素が発生します。
また、炭酸カルシウムでもう一つ重要な反応が酸化カルシウム(CaO)の生成です。炭酸カルシウムを熱すると、炭酸カルシウムが分解することで、酸化カルシウムと二酸化炭素が生成されます。
- CaCO3 → CaO + CO2
酸化カルシウムCaO、水酸化カルシウムCa(OH)2の性質
酸化カルシウムCaOは生石灰とも呼ばれています。酸化カルシウムは水と反応することにより、水酸化カルシウムCa(OH)2を生成します。水酸化カルシウムは消石灰とも呼ばれています。
- CaO + H2O → Ca(OH)2
アルカリ土類金属では、水酸化物は前述の通り水に溶けます。また、ほぼすべて電離することで水酸化カルシウムは強塩基性を示します。
なお二酸化炭素が存在するかどうかを判定するとき、水酸化カルシウム水溶液(石灰水)がひんぱんに利用されます。水酸化カルシウム水溶液に二酸化炭素を通すと、炭酸カルシウムによる白濁を生じます。
- Ca(OH)2 + CO2 → H2O + CaCO3
前述の通り、アルカリ土類金属の炭酸塩は水に溶けません。そのため、炭酸カルシウムは固体として析出することで白濁するのです。
ただ過剰の二酸化炭素を水溶液に通すと、炭酸水素カルシウムになることで再び溶解します。
- CaCO3 + CO2 + H2O → Ca(HCO3)2
参考までに、水酸化カルシウムに塩素Cl2を加えると、さらし粉が生成されます。
- Ca(OH)2 + Cl2 → CaCl(ClO)·H2O
無機化学では、塩素を発生させるときにさらし粉を利用すると学びます。さらし粉というのは、水酸化カルシウムと関係しているのです。
硫酸カルシウムCaSO4は過熱で焼きセッコウになる
アルカリ土類金属では、炭酸塩と硫酸塩は水に溶けないことを解説しました。そのため、硫酸カルシウムは難溶性の固体です。それでは、硫酸カルシウムはどのような用途で利用されるのでしょうか。
自然界では、硫酸カルシウムはセッコウとして硫酸カルシウム二水和物CaSO4·2H2Oで存在しています。セッコウを加熱すると、以下のように硫酸カルシウム二水和物から硫酸カルシウム半水和物になります。
- CaSO4·2H2O → CaSO4·\(\displaystyle\frac{1}{2}\)H2O + \(\displaystyle\frac{3}{2}\)H2O
硫酸カルシウム半水和物は焼きセッコウと呼ばれ、ギブスや工芸品でひんぱんに利用されます。

なお、焼きセッコウは水を加えることによってセッコウ(硫酸カルシウム二水和物)となります。そのためセッコウを焼きセッコウにしたり、反対に焼きセッコウをセッコウへ戻したりすることで、硫酸カルシウムはさまざまな場面で利用されています。
硫酸バリウムBaSO4は水に溶けにくく、医療で利用される
医療で利用されるのは硫酸カルシウムだけではありません。硫酸バリウムも医療でひんぱんに利用されています。
アルカリ土類金属では、硫酸塩は水に難溶です。硫酸バリウムは水に溶けず、空気や熱、光、酸に対しても安定です。つまり、硫酸バリウムはほかの物質と反応することがほぼありません。
硫酸バリウムの最大の特徴はX線を遮断することです。そのため、X線検査の造影剤として硫酸バリウムが利用されます。硫酸バリウムを飲むことによって、X線検査のときにX線写真を得ることができるのです。
なお硫酸バリウムは他の物質とほとんど反応せず、安定な物質であるため、飲んでも安全です。
カルシウムとバリウムはアルカリ土類金属で重要
すべての2族元素がアルカリ土類金属というわけではありません。無機化学でアルカリ土類金属を学ぶとき、ベリリウムとマグネシウムを除きましょう。アルカリ土類金属に対して、ベリリウムとマグネシウムは性質が大きく異なるからです。
これらの違いを覚えれば、アルカリ土類金属の性質も理解できるようになります。アルカリ土類金属では、単体は水と反応して水酸化物を作り、水に溶けます。ただ炭酸塩や硫酸塩は水に溶けません。また、炎症反応を示します。
化合物では炭酸カルシウム、酸化カルシウム、水酸化カルシウム、硫酸カルシウム、硫酸バリウムの性質を学びましょう。それぞれの化合物は独立しているわけではなく、性質に関係性があります。それぞれの性質を独立して覚えるのではなく、どのような関係があるのかも学べば効率的に学習できます。
アルカリ土類金属ではカルシウムとバリウムの性質が重要です。この2つの元素の特徴を学ぶことで、アルカリ土類金属の性質を理解しましょう。