高校化学など、有機化学の基礎ではアルカン、アルケン、アルキンの反応を学びます。大学化学では詳しい反応機構を学ぶものの、高校化学では有機合成反応が起こるときの結果を覚えることになります。
鎖状炭化水素で重要な化学反応には、置換反応や付加反応、付加重合反応が存在します。これらの反応が何を意味しているのか学びましょう。
また当然ながら、アルカンやアルケン、アルキンで反応性が異なります。そのため、それぞれの炭化水素でどの種類の反応が進行するのか理解しなければいけません。
アルカンに特徴的な反応があれば、二重結合や三重結合があるために進行する反応もあります。そこでアルカン、アルケン、アルキンで起こる合成反応を確認していきます。
もくじ
アルカンはCnH2n+2で表され、光によってハロゲンと置換反応を起こす
アルカンの分子式はCnH2n+2で表されます。分子式CnH2n+2を覚える必要はなく、メタンやエタン、プロパンの化学式を記せばアルカンの分子式を得ることができます。
- メタン:CH4
- エタン:C2H6
- プロパン:C3H8

メタンやエタンの化学式を利用すれば、CnH2n+2を導き出すことが可能です。
なお分子量が大きくなるほど、アルカンは沸点や融点が高くなります。これについては当然であり、分子量が大きくなるほどファンデルワールス力(分子間力)が大きくなって、沸点と融点は上昇します。
・光を当てるとCl2やBr2と置換反応を起こす
それでは、アルカンに特徴的な反応には何があるのでしょうか。光を当てると、アルカンはハロゲンと反応します。具体的には、Cl2と反応すると塩化水素を発生させ、Br2と反応すると臭化水素を発生させます。
また、炭素原子に結合していた水素はハロゲン(ClやBr)に置き換わります。それまで結合していた原子がほかの原子に置き換わる場合、置換反応と呼ばれます。例えばCl2が存在する状態でエタンに光を当てると、クロロエタンを生じます。HがClに置き換わるのです。
- C2H6 + Cl2 → C2H5Cl + HCl
反応機構はラジカル反応であり、大学有機化学の中でも非常に難しい分野になります。ひとまず、高校化学では「光によってアルカンとハロゲンが反応し、置換反応が起こる」と理解すれば十分です。
アルケン(CnH2n):脱水反応によるエチレン生成と縮合によるジエチルエーテルの生成
次はアルケンの合成や反応を確認しましょう。アルカンは単結合のみの化合物であるため、反応性が非常に低いです。そのため、ラジカル反応のような反応性の高い化学反応でなければ反応は進行しません。
一方、アルケンはどのような化学反応を起こすのでしょうか。まず、アルケンの合成反応を確認しましょう。
アルケンは構造内に二重結合があり、化学式はCnH2nで表されます。アルケンを合成するとき、濃硫酸による脱水反応を利用します。濃硫酸には、加熱によって分子内のH2Oを取り去る働きがあります。そのためアルコールを加熱すると、分子内脱水によってアルケンを生じます。
例えばエタノールC2H5OHに濃硫酸を加え、160~170℃で熱するとエチレンが生成されます。
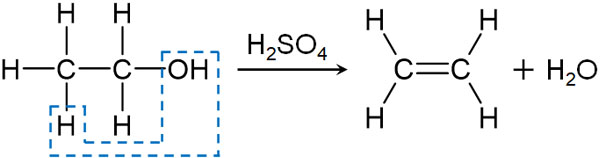
濃硫酸に脱水作用があることを学んでいる場合、なぜアルコールを用いた脱水反応が起こるのか理解するのは難しくありません。
・温度が低いと縮合によってジエチルエーテルを生じる
なお反応させる温度が低いと、エチレンではなくジエチルエーテルを生じます。エタノールC2H5OHに濃硫酸を加え、130~140℃で加熱すると、分子間で脱水反応が起こります。先ほどとは異なり、分子内ではなく、温度が低いと分子間で脱水反応が起こることに注意しましょう。
分子間での脱水反応であるため、以下のように2つのアルコールを用いてH2Oが取り去られ、1つの分子(ジエチルエーテル)になります。
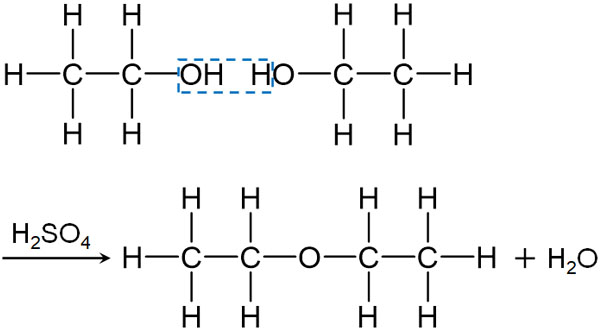
ジエチルエーテルが合成されるとき、H2Oを失うことで2つの分子が1つの分子になります。
分子の脱離(今回の例ではH2Oの脱離)を伴いながら2つの分子(または複数の分子)が反応し、新たな化合物が合成される反応を縮合反応といいます。エタノールを用いるジエチルエーテルの合成は縮合反応です。
付加反応はアルケンで一般的な反応
それでは、アルケンはどのような反応をするのでしょうか。アルケンで有名な反応は付加反応です。二重結合(または三重結合)をもつ化合物では付加反応が起こります。
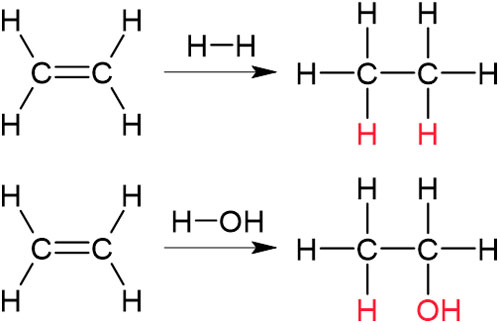
アルケンには二重結合があり、二本の手を利用して結合しています。付加反応では二重結合が切れ、単結合になります。そうなると、2つの炭素原子はそれぞれ反応化合物と新たな結合を作ります。例えば、エチレンは臭素Br2と反応して1,2-ジブロモエタンとなります。

二重結合(または三重結合)が開裂し、反応化合物が分子の中へすべて組み込まれる場合、付加反応といいます。この反応では二重結合が開裂し、臭素原子が2つとも新たな化合物内に存在しているため、付加反応であるとわかります。
臭素は赤褐色です。エチレンを加えて赤褐色が消え、無色になる場合、「アルケンと臭素が反応して1,2-ジブロモエタンが生成した」と推測できます。
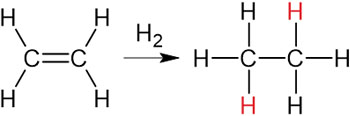
なお、アルケンへの付加反応はハロゲン以外の分子でも起こります。例えばエチレンとH2を反応させるとエタンを得ることができます。またエチレンとH2Oを反応させると、エタノールを得られます。
アルカン(飽和炭化水素)とは異なり、アルケン(不飽和炭化水素)は比較的反応性が高いです。この理由として、二重結合を利用する付加反応が可能になるからです。
付加重合反応により、多くの分子が連なる
アルケンによる付加反応では、同じ物質が付加反応を起こして多くの分子が連なることがあります。例えばエチレンが付加反応を起こすとき、エチレン同士で反応を起こすのです。
多くの分子が結合し、連なる反応を重合といいます。付加反応による重合を特に付加重合といいます。例えばエチレンが付加重合すると、以下のように無数の分子が連なります。
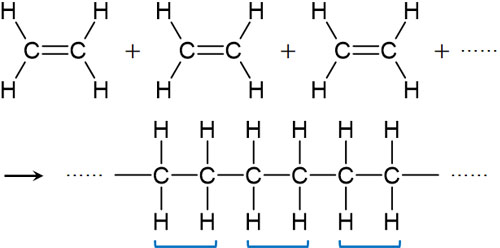
付加反応と重合反応が同時に起こることで、この反応が進行します。付加重合反応を化学式で記すと以下のようになります。
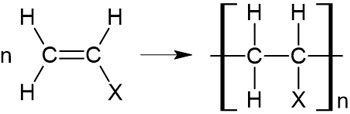
同じ化合物が繰り返し付加反応し、連なることになるため、化学式ではこのように表すのです。
なお、重合反応によって化合物は高分子になります。高分子化合物を重合体(ポリマー)といいます。一方、ポリマーの原料となる化合物単体を単量体(モノマー)といいます。
例えば、ポリエチレン(ポリマー)に対するモノマーはエチレンです。モノマー(エチレン)が付加重合することにより、ポリマー(ポリエチレン)となるのです。
オゾンによる酸化開裂反応でカルボニル基を生じる
ひんぱんに利用される反応ではないものの、アルケンの反応ではオゾンを利用することがあります。酸素に比べてオゾンは安定性が低く、酸化力が非常に強いことで知られています。
オゾンによってアルケンの二重結合が切断され、Oが結合します。これにより、カルボニル基(-C=O)が生成されます。また酸素が結合するため、酸化反応であるとわかります。
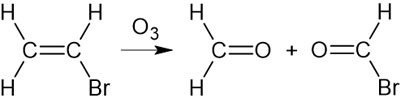
この酸化開裂反応をオゾン分解(オゾン開裂)といいます。なおオゾン分解はあまり重要な反応ではなく、有機化学の研究を行う実験室でも利用されることは稀です。ただ有機化学の試験問題では出されることがあります。
なお、オゾン分解の反応機構は複雑です。そのため、大学で有機化学を学ぶ人のみ専門書でオゾンによる酸化開裂反応の反応機構を学びましょう。
アルキンの性質:アセチレンの炭素-炭素結合の距離と合成
次にアルキンの反応を確認しましょう。三重結合をもつアルキンの化学式はCnH2n-2で表すことができます。
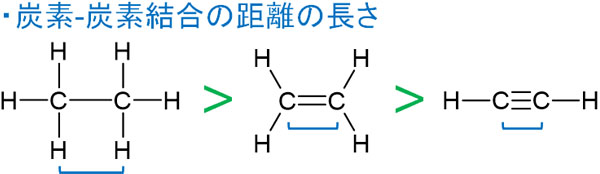
アルキンの中でも、特に重要な化合物がアセチレンC2H2です。アセチレンは直線形であり、炭素と炭素の結合距離が短いです。
エタン、エチレン、アセチレンを比較すると、単結合をもつエタンの炭素-炭素結合が最も長いです。ただ二重結合があると、二本の手でより強力に結合するため、エチレンはエタンよりも炭素-炭素結合が短くなります。
またアセチレンでは、三本の手で結合を作ります。そのため、エタンやエチレンに比べて、炭素-炭素結合が短いです。
それでは、アセチレンC2H2を合成するにはどうすればいいのでしょうか。最も一般的なアセチレンの合成方法は、炭化カルシウムCaC2に水を加える方法です。
- CaC2 + 2H2O → Ca(OH)2 + C2H2
アセチレンの合成方法は覚えてしまいましょう。
アセチレンへの付加反応:アルケンを経てアルカンが生成される
二重結合と同様に、三重結合は付加反応が進行します。例えばアセチレンC2H2にH2を反応させるとエチレンC2H4になります。
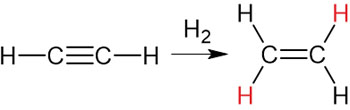
ただエチレンの生成で反応を止めるのは難しいため、エチレンはH2と付加反応を起こしてエタンになります。エチレンの付加反応は先ほど解説しました。
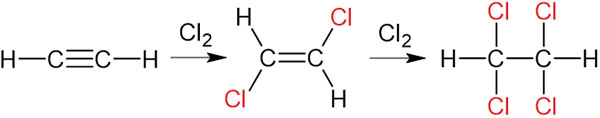
なおH2の代わりにCl2を用いる場合、1,1,2,2,-テトラクロロエタンを得られます。
アルケンへの付加反応を理解していれば、アルキンへの付加反応も容易に理解できます。
・水とアセチレンが反応するとアルデヒドを生じる
なお、アセチレンへの付加反応で特殊な例が水による付加反応です。アセチレンへH2Oが付加するとき、生成物はアルコールではなくアルデヒドになります。
アセチレンへH2Oが付加すると、以下のようにビニルアルコールが生成されます。
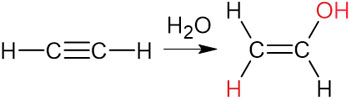
ただ、二重結合の炭素に-OHが結合している状態は不安定です。そのため、ビニルアルコールはすぐにアルデヒド(-CHO)へと変化します。
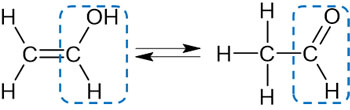
アセチレンなどのアルキンにH2Oが付加反応を起こす場合、アルコールではなくアルデヒドが生成されることを理解しましょう。
・鉄触媒を利用してベンゼンの合成が可能
ほかにも、アセチレンを用いる有名な反応がベンゼンの合成です。鉄触媒を利用し、3つのアセチレンを重合させるとベンゼンを生じます。

有機化学の研究室でベンゼンの合成をすることはありません。ただ、知識として知っておくといいです。
アルキンによる付加反応後の付加重合
先ほど解説した通り、アルキンに付加反応が起こることによってアルケンが生成されます。このとき二重結合に対して再び付加反応を生じることがあれば、付加重合を生じることもあります。つまり、アルキンを用いてポリマーを合成することができるのです。
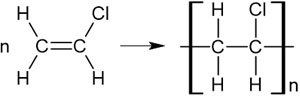
例として、アセチレンに塩化水素HClを反応させる場面を考えてみましょう。アセチレンに塩化水素が付加すると、塩化ビニルを生じます。

その後、触媒を用いて塩化ビニルを反応させると付加重合反応を起こし、ポリ塩化ビニルになります。
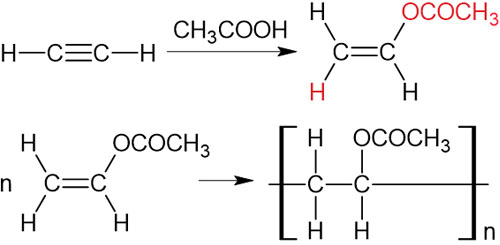
同様に、アセチレンと酢酸を反応させてみましょう。この場合、アセチレンは酢酸ビニルになります。また触媒存在下で反応させると、ポリ酢酸ビニルになります。
次に、シアン化水素HCNとアセチレンを反応させましょう。アセチレンにシアン化水素が付加するとアクリロニトリルになります。触媒を用いてアクリロニトリルを付加重合させるとポリアクリロニトリルになります。
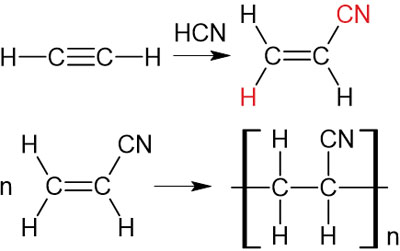
アルキンを利用する場合、付加反応の後、付加重合させることが可能です。
・ビニル基を作り、付加重合させる
先ほどの付加重合反応には共通点があり、アルケン生成物はビニル基(CH2=CH-)を保有しています。以下がビニル基に該当します。
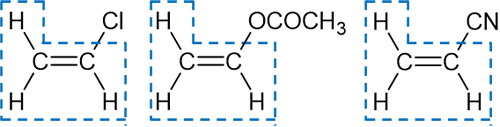
ビニル基を有する化合物が生成する場合、アルケン(モノマー)からポリマーを合成できるのです。
シクロアルカン(脂環式炭化水素)の反応性
それでは、シクロアルカンの反応性を確認しましょう。二重結合をもたないシクロアルカンはCnH2nの化学式で表すことができます。
シクロアルカンの化学式はアルケンと同じです。ただシクロアルカンは付加反応に関与しません。例えばBr2を加えても、シクロアルカンでは付加反応が進行しません。
二重結合をもつシクロアルケンや三重結合をもつシクロアルキンの場合、付加反応が起こります。しかし、シクロアルカンは単結合のみをもつので付加反応が起こらないのです。シクロアルカンは鎖状のアルカンと似た性質をもつと考えましょう。
例えばシクロヘキサンに対してBr2を加え、光照射すると反応が進行します。光を与えることによってラジカル反応が起こるのです。この反応については、アルカンに光照射する場合と同じです。
アルカン、アルケン、アルキンの合成反応
高校化学で有機化学を学ぶ場合、それぞれの化合物がどのような反応を起こすのか覚えましょう。詳しい反応機構を理解する必要はなく、反応物と生成物を学ぶのです。
アルカンやシクロアルカンは単結合のみを保有する化合物であるため反応性が悪いです。そのため、ラジカル反応など反応性の高い条件でなければ反応は進行しません。
一方、アルケンやアルキンでは付加反応または付加重合反応が進行します。反応させる試薬や条件によって生成物は異なるものの、容易に合成反応が進行します。またアルケンにオゾンを反応させる場合、オゾン分解によってカルボニル基をもつ化合物を得られます。
炭化水素を用いる合成反応は有機化学の基礎です。そこで、どのような化合物を生じるのか理解しましょう。