溶媒にどれだけの化合物が溶けるのかを表すのが溶解度です。水の量が多ければ、それだけ多くの化合物が溶けます。また温度が高ければ、その分だけ多くの化合物が溶けます。つまり、溶媒(水などの液体)に溶ける化合物の量は状況によって変化します。
溶解度を学ぶとき、飽和溶液や溶解平衡を習います。高校化学では、どれだけの量の化合物を利用することによって飽和溶液になるのか計算できるようにならなければいけません。
また溶解度を利用することによって再結晶が可能になります。結晶として、溶液から化合物を取り出す操作が再結晶です。温度の違いにより、どれだけの量の結晶が析出するのか計算できるようになりましょう。
高校化学で溶解度の問題が出されるとき、計算問題を解くことになります。そこで溶解度の概念を学ぶだけでなく、計算問題を解けるようになりましょう。
もくじ
化合物がもつ溶解度:飽和溶液と溶解平衡
水などの溶媒に溶けるのは主にイオン化合物です。正確にいうと、有機化合物は有機溶媒に溶けるため、溶解度で重要なのはイオン化合物ではありません。ただ溶解度を学ぶとき、有機溶媒に溶かす場面ではなく、水に溶かす例がひんぱんに利用されるため、水とイオン化合物の溶解度で話を進めていきます。
すべての化合物には、それぞれ異なった溶解度があります。溶解度とは、どれだけ溶媒に溶けることができるのかを意味します。このとき、水の量や温度によって溶ける物質の量は異なります。
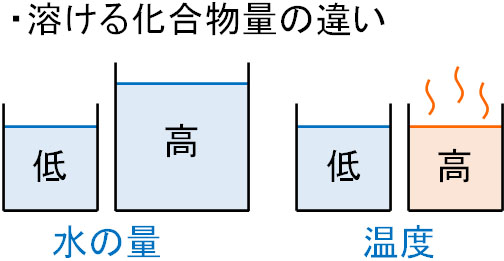
そこで溶解度の計算をするとき、溶媒の量(水の重さ:g)を100gに固定しましょう。つまり、100gの水にどれだけ溶けるのかを表す指標として溶解度を利用します。
もし溶解度よりも多くの化合物が水に存在すると、それ以上は水に溶けることができません。溶解度よりも大きい部分については、化合物は溶けずに水の中に残ることになります。
大量の塩化ナトリウム(NaCl:食塩)を水に溶かすとき、一部は溶けるものの、残りは溶けずに水中に存在することは予想できると思います。温度を上げればさらに溶けることができるものの、温度が一定の場合、溶媒に溶ける化合物の量は決まっています。
なお溶質(溶けている物質)が溶媒に限界まで溶けているとき、その溶液を飽和溶液といいます。飽和溶液では、「化合物が水に溶けるスピード」と「化合物が結晶として析出するスピード」が同じです。この状態を溶解平衡といいます。
温度で異なる溶解度曲線
水の量が一定の場合、溶解量は温度によって変わります。このとき私たちが利用するのが溶解度曲線です。温度が変化することによって、化合物の溶解度がどのように変化するのか確認できるのです。例えば以下は、硝酸カリウム(KNO3)と塩化ナトリウム(NaCl)の溶解度曲線です。
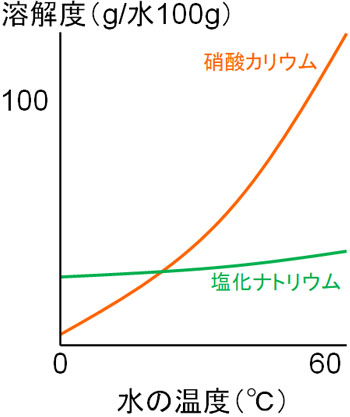
塩化ナトリウムの場合、温度を上げても溶解度が増えるのは少しだけです。一方、硝酸カリウムの場合は温度上昇によって溶解度が大きく上がります。
温度上昇によって、化合物の溶解度が上昇する現象は共通しています。温度が高いと水分子がもつエネルギーは上昇するため、より多くの化合物を溶かすようになるのです。ただ、どれだけ溶解度が上昇するのかは化合物の種類によって異なります。
溶解度曲線を利用して再結晶を行う
温度によって溶解度が異なる事実がなぜ重要なのでしょうか。それは、温度差によって再結晶をすることができるからです。純度の低い化合物について、高純度の化合物として取り出す手法が再結晶です。
飽和溶液の状態から、低い温度になることによって結晶として析出します。それ以上、溶けることができないので溶液中に固体として結晶が作られるのです。例えば硝酸カリウムを溶かした後、温度を下げる場合は以下のようになります。
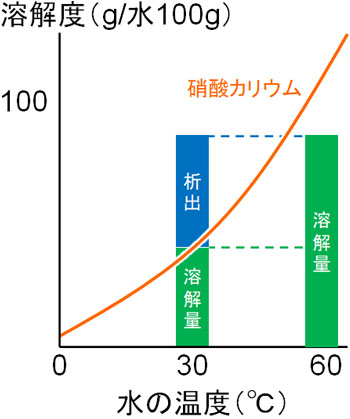
温度を下げると、溶解度が徐々に減少していきます。その後、ある時点で飽和溶液となり、さらに温度を下げることによって溶けきれない化合物が水中を漂うようになります。このとき出てくる固体が結晶であり、この操作を再結晶といいます。
純度の高い物質を取り出す作業は重要です。例えば医薬品は化学物質(小さい分子)であり、できるだけ純度を高くしなければいけません。不純物が混じっていると副作用を起こすからです。そのため、医薬品合成では必ず再結晶が行われます。
溶解度曲線から、飽和溶液の溶解量を計算する
それでは、溶解度曲線を利用して飽和溶液の溶解量(または飽和溶液に溶けている化合物の量)を計算しましょう。計算するためには溶解度曲線を確認しなければいけません。そこで、以下の溶解度曲線を利用しましょう。

溶解度曲線により、水100g中に硝酸カリウム(KNO3)を溶かすことのできる温度ごとの量がわかります。
- 10℃:20gの硝酸カリウムを溶かすことができる
- 40℃:64gの硝酸カリウムを溶かすことができる
- 60℃:110gの硝酸カリウムを溶かすことができる
化学では、溶解度曲線を利用する問題が出されます。例えば、以下の問題の答えは何でしょうか。
- 60℃の水に硝酸カリウムを最大まで溶かし、飽和溶液を作りました。飽和溶液の重さが630gの場合、溶けている硝酸カリウムの量はいくらでしょうか。
溶けている硝酸カリウムの量を\(x\)gとしましょう。また60℃では、水100gに対して、硝酸カリウムを110g溶かすことができます。つまり飽和溶液の場合、水の重さと硝酸カリウムの重さを合計すると210gになります。
「水+硝酸カリウム」が210gのとき、硝酸カリウムの量は110gです。また「水+硝酸カリウム」が630gのとき、硝酸カリウムの量は\(x\)gです。そこで、以下の計算式によって答えを出しましょう。
\(210:110=630:x\)
\(210x=110×630\)
\(x=110×3\)
\(x=330\)
こうして、溶液には330gの硝酸カリウムが溶けているとわかります。
再結晶での硝酸カリウムの析出量を計算する
次に、再結晶をするときの結晶の析出量を計算しましょう。溶解度がわかっている場合、どれだけの結晶が析出するのかわかります。
例えば、330gの硝酸カリウムが溶けている先ほどの化合物について、10℃まで冷やすときに析出する結晶の量はいくらでしょうか。
溶けている硝酸カリウムの量がわかれば、水(溶媒)の量もわかります。「水+硝酸カリウム」が630gであるため、水の重さは300gです。
10℃の場合、100gの水に20gの硝酸カリウムが溶けます。それでは同じ条件のとき、300gの水には何グラムの硝酸カリウムが溶けるでしょうか。以下のように計算しましょう。
\(100:20=300:x\)
\(100x=20×300\)
\(x=60\)
こうして、10℃だと300gの水には60gの硝酸カリウムが溶けるとわかります。先ほどの計算より、60℃では300gの水に対して330gの硝酸カリウムが溶けています。そこで以下のように引き算をすれば、結晶として析出する量がわかります。
\(330-60=270\)
こうして、再結晶によって得られる結晶の量は270gとわかりました。
飽和溶液にするために必要な化合物の量
場合によっては、飽和溶液を作るために必要な化合物の量を計算しなければいけないこともあります。計算方法はこれまでのやり方と同じであり、特定の温度について、溶解度を利用して溶ける化合物の量を計算しましょう。
例えば、以下の問題の答えは何でしょうか。
- 質量パーセント濃度10%の硝酸カリウム水溶液400gについて、40℃で飽和溶液にするために必要な量はいくらでしょうか。
質量パーセント濃度10%の硝酸カリウム水溶液400gには、40gの硝酸カリウム(KNO3)が溶けているとわかります。つまり、硝酸カリウム水溶液400gの内訳は「水が360g、硝酸カリウムが40g」になります。
水が360gあるとき、40℃では最大で何グラムの硝酸カリウムが溶けるでしょうか。40℃では水100gに硝酸カリウムが64g溶けるため、以下の計算をしましょう。
\(100:64=360:x\)
\(100x=64×360\)
\(x=230.4\)
こうして、40℃では水360gに対して230.4gの硝酸カリウムが溶けるとわかりました。また、既に溶けている硝酸カリウムは40gです。そのため40℃で飽和溶液にするためには190.4gの硝酸カリウムを溶かせばいいとわかります。
\(230.4-40=190.4\)
蒸発によって析出する結晶の量
溶解度を用いた計算について、もう一つ例題を解きましょう。水は放置していると蒸発します。前述の通り、水の量が少なくなれば、その分だけ溶けることが可能な化合物の量は減ります。つまり温度変化だけでなく、水の蒸発によっても再結晶が起こります。
そこで、溶媒が減った場合に析出する結晶の量を計算できるようになりましょう。この場合についても、溶けることのできる化合物の量に着目して計算していきます。
例えば、以下の問題の答えは何でしょうか。
- 飽和溶液である40℃の硝酸カリウム水溶液200gについて、20gの水が蒸発した場合、析出する結晶の量はいくらでしょうか。
まず、飽和溶液である40℃の硝酸カリウム水溶液200gにはいくらの硝酸カリウムが溶けているでしょうか。「水+硝酸カリウム」が200gになる必要があります。そのため硝酸カリウムの量を\(x\)gとすると、水の重さは\((200-x)\)gになります。
なお、40℃では100gの水に硝酸カリウムが64g溶けます。また\((200-x)\)gの水に硝酸カリウムが\(x\)g溶けるため、以下の計算式によって\(x\)gの値を出しましょう。
\(100:64=200-x:x\)
\(100x=64(200-x)\)
\(100x=12800-64x\)
\(164x=12800\)
\(x≒78.0\)
こうして、78.0gの硝酸カリウムが溶けているとわかります。また、\(200-78=122\)gの水が存在するとわかります。
次に、20gの水が蒸発する場面を考えましょう。122gの水について、20gが蒸発すると102gになります。つまり、102gの水に溶けることのできる硝酸カリウムを計算すればいいです。40℃では100gの水について64g溶けるため、以下の計算によって102gに溶ける硝酸カリウムの量を求めましょう。
\(100:64=102:y\)
\(100y=64×102\)
\(y=65.28\)
こうして102gの水に対して、硝酸カリウムは最大で65.28g溶けます。122gの水(最大78.0gの硝酸カリウムが溶ける)について、20gが蒸発することで102gの水(最大65.28gが溶ける)になります。そのため、正解は12.72gです。
\(78.0-65.28=12.72\)
※有効数字を考慮する場合、12.7gや13gも正解です。
・別解によって問題を解く
参考までに、残った水溶液ではなく、蒸発した水溶液に着目すると計算式はより単純になります。つまり、蒸発した水に何グラムの硝酸カリウムが溶けていたのかを計算するのです。蒸発した水に溶けていた硝酸カリウムの分だけ、結晶として析出するからです。
40℃の水では、20gの水に何グラムの硝酸カリウムが溶けるでしょうか。100gの水に64g溶けるため、以下の計算式を作りましょう。
\(100:64=20:x\)
\(100x=64×20\)
\(x=12.8\)
先ほどの答えである12.72gと異なりますが、両方とも正解です。前の計算では割り切れない数字を利用したため、答えの数字がわずかに異なります。また、科学実験で小さい数字は誤差と考えるので特に影響はありません。
水和物を溶かすときは水の量が増える
次に、水和物を溶かすときの計算問題も解けるようになりましょう。水和物の場合、化合物は水を保有しています。そのため水和物を溶かすと、その分だけ水の量が増えます。
有名な水和物としては硫酸銅(Ⅱ)五水和物(CuSO4・5H2O)が知られています。硫酸銅(Ⅱ)五水和物には5つのH2Oが結合しています。つまり硫酸銅(Ⅱ)五水和物を1mol溶かすと、水溶液では5molの水が増えます。
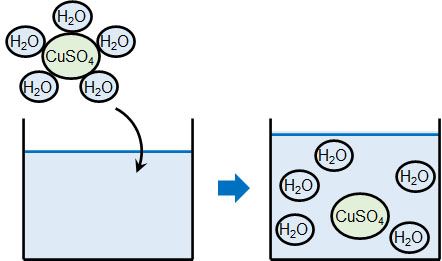
そのため水和物を溶かすとき、水の量が増えることを考慮して計算しなければいけません。例えば、以下の問題の答えは何でしょうか。
- 60℃の水50gに硫酸銅(Ⅱ)五水和物(CuSO4・5H2O)は何g溶けるでしょうか。なお、硫酸銅(Ⅱ)は60℃で水100gに40g溶けることができます。また原子量はH=1、O=16、S=32、Cu=64です。
硫酸銅(Ⅱ)五水和物(CuSO4・5H2O)が何g溶けるのかを知りたいため、硫酸銅(Ⅱ)五水和物が水に溶ける量を\(x\)gにしましょう。
CuSO4の式量は160であり、CuSO4・5H2Oの式量は250です。それではCuSO4・5H2Oが\(x\)g溶けるとき、CuSO4とH2Oはそれぞれ何gに相当するでしょうか。
CuSO4・5H2Oの式量が250であり、CuSO4の式量が160なので、CuSO4は\(\displaystyle\frac{160x}{250}\)gが溶けることになります。またCuSO4・5H2Oの式量が250であり、5H2Oの重さは90なので、H2Oは\(\displaystyle\frac{90x}{250}\)gが溶けることになります。つまりCuSO4・5H2Oを\(x\)g溶かすとき、50gの水に対して\(\displaystyle\frac{90x}{250}\)gの水が加わります。

そこで、比例式を利用して計算しましょう。100gの水に対してCuSO4は40g溶けます。一方、\(50+\displaystyle\frac{90x}{250}\)gの水に対して、CuSO4は\(\displaystyle\frac{160x}{250}\)g溶けます。そのため、以下の式を作ることができます。
\(100:40=\left(50+\displaystyle\frac{90x}{250}\right):\displaystyle\frac{160x}{250}\)
\(100×\displaystyle\frac{160x}{250}=40×\left(50+\displaystyle\frac{90x}{250}\right)\)
\(2.5×160x=12500+90x\)
\(400x-90x=12500\)
\(310x=12500\)
\(x≒40.3\)
こうして、40.3gの硫酸銅(Ⅱ)五水和物(CuSO4・5H2O)が溶けるとわかります。水和物の計算問題では、化合物が含む水を考慮して溶解度の計算をしましょう。
溶解度曲線を利用し、化合物の量を計算する
純度の高い化合物を得る方法に再結晶があります。再結晶を理解するためには溶解度を学ばなければいけません。
溶解度の問題が化学で出される場合、高校化学では計算問題になります。そこで溶解度曲線を利用して、計算式を作れるようになりましょう。
溶解度を利用する問題では、さまざまなパターンの問題を作れます。ただ計算式の作り方は決まっており、水の量と溶けている溶質の量に着目しましょう。その後、比例式を利用することによって問題を解くことができます。これは、水和物の問題も同様です。
化学の計算問題は解き方が決まっています。そこで、どのように問題を解けばいいのか理解しましょう。






