有機化学で重要となる要素に置換基の影響があります。アルキル鎖やベンゼン環に対して、どのような官能基が結合しているのかによって分子の性質が変わるのです。
置換基による影響としては、特に重要な影響として誘起効果(I効果)と共鳴効果(R効果)があります。結合している置換基が変わることによって、分子の酸性度が違ってきます。また、結合している置換基がアルキル鎖かベンゼン環によっても様子が変わります。
置換基には、電子供与性と電子吸引性があります。電子を与えるのが電子供与基であり、電子を引っ張るのが電子吸引基です。これらを見極めることで、分子の反応性を見分けられるようになります。
そこで、誘起効果や共鳴効果の原理を理解するようにしましょう。置換基の性質を理解し、電子供与基と電子吸引基の見分け方を学べば、酸性度がどうなっているのかを把握できるようになります。
もくじ
誘起効果(I効果)と共鳴効果(R効果)の違い
まず、誘起効果(I効果)とは何でしょうか。また、共鳴効果(R効果)とは何でしょうか。これらは両方とも、分子に結合している官能基による影響だと考えましょう。どのような置換基が結合しているのかによって、酸性度が異なるなど、多くの違いが出てくるようになります。
両者の違いとしては、以下のようになります。
- 誘起効果:σ結合(単結合)による影響
- 共鳴効果:π結合(二重結合や三重結合)による影響
電子軌道にはs軌道やp軌道があり、これらの軌道が結合を作ります。これらs軌道やp軌道による結合の中でも、単結合がσ結合です。一本の鎖でつながっている場合、どれもσ結合です。σ結合による置換基の影響が誘起効果です。
一方、分子によっては二重結合や三重結合を作ることがあります。二重結合や三重結合を形成する部分はπ結合と呼ばれています。π結合があれば、分子は共鳴構造を書けます。置換基によって共鳴した結果、配向性(ベンゼン環上の反応性)や酸性度が変わるのが共鳴効果です。
大まかに考えると、誘起効果(I効果)はアルキル鎖に影響し、共鳴効果(R効果)はベンゼン環に影響すると理解しましょう。
誘起効果による電気陰性度の違いで酸性度が異なる
単結合(σ結合)に影響を与えるのが誘起効果です。どのようなとき、誘起効果が表れるのでしょうか。これは、電気陰性度の高い原子(または分子)が結合したときに起こります。
特に重要なのがアルキル鎖に結合したときです。二重結合や三重結合のないアルキル鎖では、共鳴が起こることはありません。そのためアルキル鎖では、誘起効果だけ考慮すればいいです。
電気陰性度の高い原子が結合すると、電子を強く引き寄せるようになります。その結果、同じ分子であってもプラスとマイナスの電荷を生じるようになります。これが分極です。水やアンモニア、塩化水素などは分極していることで知られています。
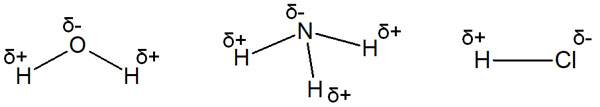
こうした、電気陰性度の違いによる分極はアルキル鎖でも起こります。アルキル鎖に電気陰性度の高い置換基が結合することで、酸性度に違いを生じるようになるのです。
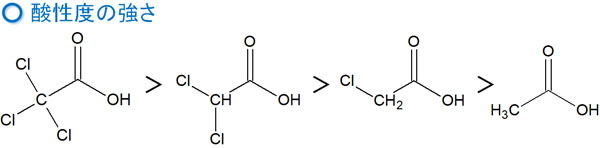
例えば、酢酸は酸性物質として知られています。カルボン酸があると、酸性を示すのです。ただ同じカルボン酸であっても、その周辺炭素にどのような置換基が存在するのかによって、酸性度(酸性の強さ)に違いが生まれます。
酢酸(CH3COOH)に対して、例えばハロゲンである塩素原子が1つ結合すればどうでしょうか。この場合、以下のようになります。

塩素原子が結合することによって、電子は塩素原子に引き寄せられます。その結果、クロロ酢酸はカルボン酸よりもマイナスに荷電しやすくなります。これは、クロロ酢酸の酸性度が高くなることを意味しています。
ハロゲンによる影響で電子が引っ張られ、結果としてクロロ酢酸は、カルボン酸よりも酸性が強くなります。
置換基による影響で電子が引っ張られる働きが誘起効果です。この影響により、酸性度の強弱が関わるようになります。もちろん、ハロゲンが多く結合するほど酸性度は大きくなります。
酸性度の例で解説しましたが、同じことは塩基性度にも影響します。誘起効果は塩基性の強弱に関わると考えましょう。
なお電気陰性度の強い官能基では、多くのケースで誘起効果が関与します。アルキル鎖に酸素原子や窒素原子、ハロゲンが結合する場合、誘起効果を引き起こして電子密度が低くなります。
- ニトロ基(-NO2)
- アミノ基(-NH2)
- シアノ基(-CN)
- カルボニル基(-CO)
- カルボキシ基(-COOH)
- スルホン基(-SO3H)
- メトキシ基(-OCH3)
- ヒドロキシ基(-OH)
- ハロゲン(-Cl、-Br、-I)
これらはすべて、アルキル鎖に結合することで電子を引き寄せて誘起効果を起こします。酸素原子や窒素原子、ハロゲンのある官能基では、どれも電子吸引基となります。
電子吸引基の影響範囲は限定的
それでは、電子吸引基による誘起効果の範囲はどれくらいなのでしょうか。これについて、限定的だと理解しましょう。
電気陰性度によって電子を引き寄せるとはいっても、距離が離れていると影響は少ないです。電子吸引基が結合している隣の炭素原子については、誘起効果による影響があります。しかし、距離が離れると電気陰性度による影響は少なくなります。
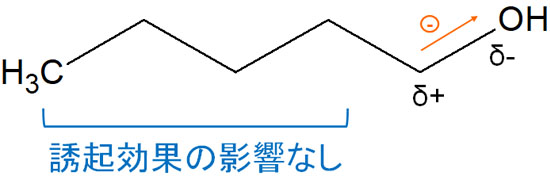
誘起効果によって電子密度が低くなるとはいっても、影響の範囲は少ないです。
・炭素原子があれば、電子密度が高くなる
参考までに、炭素原子があると電子密度が高くなります。酸素原子や窒素原子、ハロゲンとは異なり、炭素原子は電子を押し出す働きがあります。電子吸引とは逆の作用をするのです。
そのため炭素原子が多く結合している場合、電子密度が高くなると考えましょう。
共鳴効果は電子の非局在化を考慮する
アルキル鎖での誘起効果は単純です。電気陰性度の大きい官能基が結合することで、電子密度が低くなることが誘起効果(I効果)です。その結果、酸性度(または塩基性度)が高くなります。
一方で共鳴効果(R効果)は少し複雑になります。単結合での影響だけを考えればよかった誘起効果とは異なり、共鳴効果では二重結合や三重結合の影響を考えなければいけません。π結合による影響が共鳴効果です。
これら二重結合の中でも、共鳴効果では特に芳香環化合物(ベンゼン環が関与する化合物)の配向性や酸性度に深く影響します。また有機化学反応の反応速度にも関与します。
共役構造を有する化合物で考慮するべきなのが共鳴効果です。ただ大まかに考えると「ベンゼン環の反応性に関与するものが共鳴効果」と理解すればいいです。
誘起効果より、共鳴効果のほうが強い
酸素原子や窒素原子は電子吸引基の代表例です。そのためヒドロキシ基(-OH)やメトキシ基(-OCH3)、アミノ基(-NH2)がアルキル鎖に結合すると電子吸引基になります。これらの置換基が結合すれば、どれも電子吸引基になると考えればいいです。
一方で芳香環化合物では状況が違います。置換基が電子供与基になることがあれば、電子吸引基になることもあります。これは、共鳴するからです。
共鳴構造を書けるほど化合物は安定します。共鳴があれば、それに伴って電子は多くの場所に移動できるようになります。これを電子の非局在化といいます。非局在化の度合いが大きいほど、電子の状態は安定化するのです。
共鳴構造を描くためには、二重結合を有する化合物であることが必須です。ベンゼン環は二重結合があるため、芳香環化合物はどれも共鳴構造を書くことができます。例えば、以下はアニリンの共鳴です。
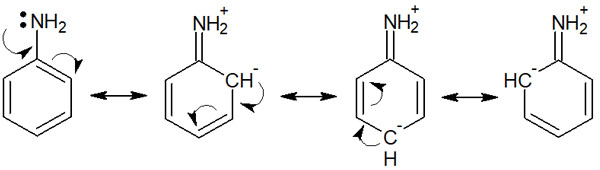
アニリンの窒素原子に着目すると、窒素原子からベンゼン環に向かって電子を押し出していることが分かります。つまり、アニリンの窒素は電子供与基として働いていることが分かります。
窒素原子のため、誘起効果によって電子を引き寄せる力が存在します。しかし誘起効果に比べると、共鳴による電子の非局在化の影響はより強いです。その結果、ベンゼン環上のアミノ基は電子供与基になります。
芳香環での電子供与基と電子吸引基の見分け方
それでは、どのようにしてベンゼン環上の電子供与基と電子吸引基を見分ければいいのでしょうか。これについては、置換基に二重結合(または三重結合)があるかどうかを確認しましょう。
例えば、以下の置換基はベンゼン環上で電子供与基として関与します。
- メトキシ基(-OCH3)
- ヒドロキシ基(-OH)
- アミノ基(-NH2)
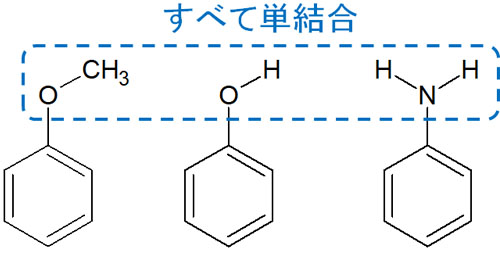
ベンゼン環上に直接結合している原子(酸素原子や窒素原子)に着目すると、どれも単結合であることが分かります。その結果、これらの置換基はベンゼン環上で電子供与基となります。
一方で置換基内に二重結合(または三重結合)があるとどうでしょうか。この場合、電子吸引基として働きます。
- カルボニル基(-CO)
- カルボキシ基(-COOH)
- スルホン基(-SO3H)
- ニトロ基(-NO2)
- シアノ基(-CN)
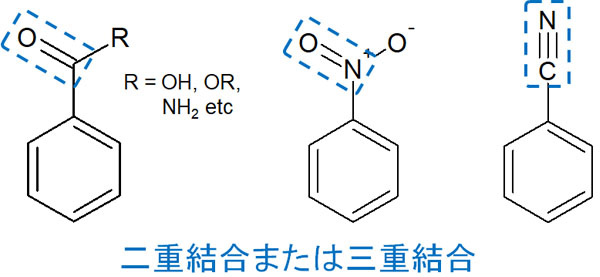
二重結合(または三重結合)があると、共鳴によって置換基の中に電子を取り込むことができます。その結果、電子吸引基となります。
酸素原子や窒素原子が結合しているとき、単結合ばかりの置換であれば電子供与基になります。一方で二重結合(または三重結合)を有する置換基が結合した場合、電子吸引基になります。例外はあるものの、大まかにこのように理解しましょう。
ベンゼン環の酸性度は置換基によって異なる
アルキル鎖では電子吸引基であったとしても、芳香環化合物では電子供与基になることがあります。この事実を最初に理解しなければいけません。共鳴効果では、誘起効果と比べて複雑になりやすいです。
それでは、芳香環化合物で共鳴効果(R効果)を理解することがなぜ重要なのでしょうか。これは、酸性度に関わるからです。配向性(ベンゼン環でどの部分が化学反応を起こすのか)も変わりますが、ここでは酸性度に着目していきます。
同じ芳香族化合物であっても、置換基によって酸性度が変わります。例えばフェノール化合物を酸性度順に並べると、以下のようになります。
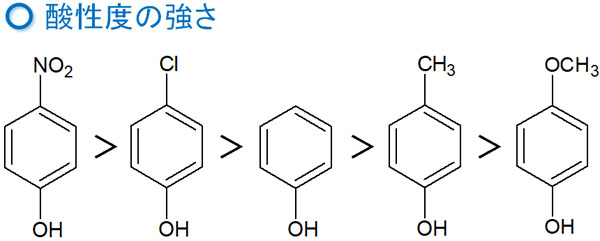
なぜ、このような違いが表れるのでしょうか
ハロゲンは誘起効果によって電子を引き寄せます。そのため、フェノールに比べて酸性度が強くなるのは理解できます。また炭素原子は電子を押し出します。電子供与基のため、フェノールに比べて酸性度は下がります。
一方で、ニトロ基とメトキシ基はどのように考えればいいのでしょうか。この2つの官能基については、誘起効果だけで考えてはいけません。共鳴効果による影響が非常に強いため、共鳴を考慮して酸性度を考えます。
共鳴構造によって電子の安定性が変わる
フェノールが酸性を示すためには、「イオンになった後に安定であるほど、酸性度が強くなる」と予想できます。そうしたとき、ニトロ基(p-ニトロフェノール)では以下のように共鳴します。
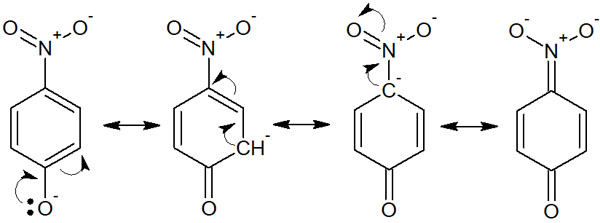
このようにフェノールが酸になったあと、多くの共鳴構造を書くことができます。また電子はニトロ基まで非局在化します。酸になるときの安定性が高いため、p-ニトロフェノールの酸性度は高いです。電子吸引基があることで、酸性度は高くなります。
一方でメトキシ基がある場合はどうでしょうか。芳香環にあるメトキシ基は電子供与基として働きます。その結果、先ほどとは逆に酸性度が低くなります。
メトキシ基が電子を提供することで共鳴する場合、以下のようになります。
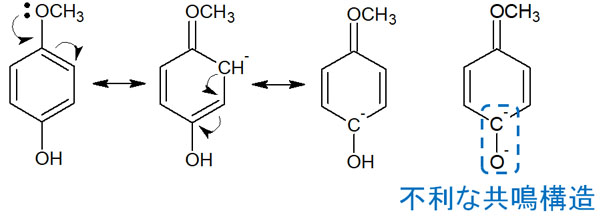
メトキシ基が電子をベンゼン環に押し出した結果、マイナスの電荷を帯びた炭素原子と酸素原子が隣り合うようになります。この状態でイオンになる場合、マイナスの電荷が隣り合って存在します。
マイナスとマイナスの電荷は反発します。つまりイオンになってフェノールが酸性を示すことを考えると、不利な共鳴構造となります。この理由から、ベンゼン環に電子供与基が存在すると酸性度を下げるように影響します。
・共鳴効果でオルト・メタ・パラの配向性が変わる
なお共鳴効果が関与するのは酸性度だけではありません。配向性も変化します。ベンゼン環の中で、どの部分で有機化学反応を起こすのかを予想するツールが配向性です。
ベンゼン環では、置換基を起点としてオルト・メタ・パラと位置があります。芳香族化合物でどこに置換基が結合するのかは、電子供与基や電子吸引基によって変化します。また配向性が違えば、芳香族化合物の反応性も変化します。
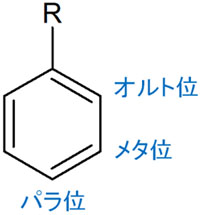
これらも共鳴効果(R効果)が影響します。
電気陰性度と共鳴が化合物の安定に寄与する
分子にはさまざまな置換基が結合しています。こうした官能基の種類によって、分子の性質が異なるようになります。
最も分かりやすいのは誘起効果(I効果)です。電気陰性度が高いほど、置換基は電子を引き寄せます。その結果、酸性度に違いを生じるようになります。なお酸性度の違いは酸性と塩基性の強弱だけでなく、反応性の違いを生じるため非常に重要です。
ただ、誘起効果では電子吸引基として関わっていた置換基であっても、芳香環化合物では電子供与基として機能することがあります。そこで、電子供与基と電子吸引基の違いを見極められるようにしておきましょう。
誘起効果に比べて、共鳴効果のほうが強いです。そのためベンゼン環上にどのような置換基があるのかによって、酸性度や配向性が大きく変わります。
分子の性質は置換基が大きく関わります。結合しているのがアルキル鎖なのかベンゼン環なのかによって、置換基は性質が変わります。この事実を理解するようにしましょう。






