化学を学ぶとき、必ず理解しなければいけない内容に原子量や分子量、式量があります。要は、原子や分子の重さを計算できるようにならなければいけません。
科学実験をするとき、必要な試薬の量を計算することになります。このとき、すべての人が原子量や分子量、式量を利用して計算します。
化合物の量を計算するとき重要になる概念が物質量(mol)とアボガドロ数です。化学では物質量として、mol(モル)という単位をひんぱんに利用します。物質量にはアボガドロ数が大きく関与しています。物質量と原子量がわかれば、必要な試薬の量や体積がわかります。
化学に限らず物理や生物を含め、多くの場面で試薬を利用します。そのため、物質量を利用して計算できることは重要です。そこで、原子量や分子量、式量の利用法を解説していきます。
もくじ
原子や分子、イオンの重さは相対質量で決まる
それぞれの物質は重さが決まっています。それでは、原子量(原子の重さ)はどのように決められているのでしょうか。
原子の重さは相対質量によって決められています。具体的には、炭素(12C)の重さを基準にしています。炭素の重さを12gとして、これを基準にしてほかの原子がどれくらいの重さをもつのか測定するのです。
そうすると、たまたま水素原子(H)は1gであり、窒素原子(N)は14g、酸素原子(O)は16gであることがわかりました。炭素の質量を基準にした相対的な重さを利用するため、原子量は相対質量によって決まります。
これは分子量(分子の重さ)や式量(組成式の重さ)も同様です。共有結合している化合物は分子を形成しています。このとき炭素(12C)の重さと比べて、どれだけ重いのか(または軽いのか)を表します。
・分子量の計算
分子量の計算は簡単であり、原子量を足すだけです。例えば、原子量が水素(H:1)、炭素(C:12)、窒素(N:14)、酸素(O:16)、塩素(Cl:35.5)のとき、分子量は以下のようになります。
- O2=16×2=32
- H2O=1×2+16=18
- NH3=14+1×3=17
- CO2=12+16×2=44
- HCl=1+35.5=36.5
このように、原子量の足し算によって分子量を計算できます。
ちなみに、原子量を覚える必要はありません。化学の問題で分子量の計算問題が出されるとき、必ず原子量が記載されています。
・式量の計算
一方、分子で表せないケースもあります。塩化ナトリウム(NaCl)のようにイオン結合している物質や銅(Cu)のように金属結合している物質の場合、物質が永久につながっていて分子で記すことができません。この場合、式量を利用します。
最も簡単な整数比を利用して物質を表す方法が組成式です。例えば、塩化ナトリウムはナトリウム(Na)と塩素(Cl)が1:1の割合でイオン結合しているため、組成式はNaClです。また式量というのは、組成式に対する重さを表します。
例えば原子量がそれぞれ水素(H:1)、窒素(N:14)、ナトリウム(Na:23)、塩素(Cl:35.5)のとき、以下のように式量を計算します。
- NaCl=23+35.5=58.5
- NH4Cl=14+1×4+35.5=53.5
こうして、式量を計算することができます。足し算とかけ算ができる場合、分子量や式量の計算は難しくありません。
アボガドロ数を利用して物質量(mol)を表す
それでは、原子量についてより深く確認していきましょう。先ほど、炭素原子の重さが12gと説明しました。それでは炭素原子が12gのとき、そこにはいくつの原子が存在するのでしょうか。12Cが12gのとき、存在する原子の数をかぞえると6.0×1023個になるとわかっています。
つまり12Cを6.0×1023個集めると12gになります。
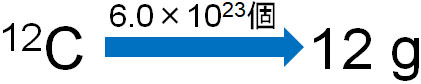
質量を計算するとき、いくつの原子が存在するのか定義することは重要です。12Cを集めるとき、6.0×1023個を集めるのと、2.0×1023個を集めるのでは当然ながら重さが違います。
また前述の通り、原子量や分子量、式量は相対質量によって決まります。そこで、6.0×1023個の原子や分子を集めるとき、1molと定義しましょう。また、molを利用して表すときの量を物質量といいます。
先ほど、水素(H)の原子量が1であり、酸素(O)の原子量が16であると解説しました。これは、水素原子を6.0×1023個(1mol)集めれば、1gになることを意味します。また酸素原子を6.0×1023個(1mol)集めれば、16gになることを意味します。
これは分子量や式量も同様です。先ほど、二酸化炭素(CO2)の分子量が44と計算しました。つまりCO2を6.0×1023個(1mol)集めれば44gになります。
同位体が存在する場合、存在比を利用して計算する
ただ原子には同位体が存在します。そのため、同位体の存在比を考慮して計算しなければいけません。例えば塩素は2つの同位体が存在し、質量数と存在比は以下のようになります。
- 35Cl:存在比75.53%
- 37Cl:存在比24.47%
そのため自然界に存在する塩素では、以下の原子量になります。
\(35×0.7553+37×0.2447≒35.5\)
原子にはそれぞれ質量数があります。また、同位体が自然界に存在する割合は決まっています。そのため、同位体の存在比を利用することによって原子量の計算が可能なのです。
分子量・式量を利用して物質量の計算を行う
それでは実際に物質量の計算をしてみましょう。先ほど、わかりやすくするために単位としてgを利用しました。ただ本来、原子量や分子量、式量は相対質量であるため、gなどの単位を利用することができません。
そこで、単位(g)を利用できるようにしましょう。具体的には、モル質量(g/mol)を利用します。モル質量では、1molの原子(または分子)が集まることによって、何グラムになるのかを表します。
例えば水素原子(H)が1mol存在するとき、1gになります。酸素原子(O)が1molあると16gになります。そのため、水分子(H2O)が1molあると18gになります。
それでは、以下の問題の答えは何でしょうか。
- 炭素(C:12)、酸素(O:16)のとき、二酸化炭素(CO2)が5molあるときの重さはいくらでしょうか。
CO2の分子量は44です。そのため、以下のように計算できます。
\(44×5=220\)
こうして、二酸化炭素が5molあるときの質量は220gであるとわかります。モル質量(g/mol)と質量数(mol)をかけるため、質量数(mol)が消えて質量(g)だけが残るのです。
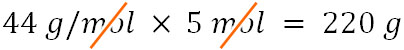
それでは、以下の問題の答えは何でしょうか。
- 原子量が水素(H:1)酸素(O:16)であり、水(H2O)が7.2gあるとき、何個の水分子が存在しますか。なお、アボガドロ数を6.0×1023とする。
H2Oの分子量は18です。そのため水(H2O)が7.2gあるとき、0.4molが存在します。
\(\displaystyle\frac{7.2}{18}=0.4\)
また、1molでは6.0×1023個の分子が存在します。そのため、2.4×1023個の水分子が存在するとわかります。
\(0.4×6.0×10^{23}=2.4×10^{23}\)
1molの気体の体積は22.4L
ここまで原子や分子の質量について解説してきました。ただ原子や分子によっては、固体や液体ではなく気体で存在することもあります。質量については、固体でも気体でも原子量(または分子量)を利用することによって質量を計算できます。モル質量を利用し、グラムを計算するのです。
ただ気体の場合、体積の計算をしなければいけない場合があります。このとき、1molあたりの気体の体積はいくらになるのでしょうか。
圧力や温度によって気体の体積は異なります。そこで、標準状態(0℃、1.0×105Pa)を想定しましょう。標準状態の場合、すべての原子や分子で1molは22.4Lになります。
つまり原子(または分子)が6.0×1023個あるとき、気体の体積は必ず22.4Lになります。そこで、以下の問題を解いてみましょう。
- 原子量が水素(H:1)、窒素(N:14)のとき、アンモニア(NH3)が4molあるときの体積や質量、分子数を計算しましょう。なお、アボガドロ数を6.0×1023とする。
4molあるため、標準状態での体積は89.6Lです。
\(4×22.4=89.6\)
また、アンモニア(NH3)の分子量は17です。そのため、質量は68gです。
\(4×17=68\)
存在する分子の数については、アボガドロ数を利用して24.0×1023個であるとわかります。
\(4×6.0×10^{23}=24.0×10^{23}\)
このように質量数を利用することによって、質量や個数だけでなく、気体の体積を計算することもできます。

化学の計算では物質量が必ず出てきます。試薬を利用して実験をするとき、必ずモル質量を利用することになります。化学に限らず物理実験や生物実験でもひんぱんに利用されるため、物質量の概念を理解するのは必須です。
原子量や分子量を学び、物質量の計算を行う
原子や分子には原子量や分子量があります。またイオン結合している化合物では式量があります。原子量を利用することにより、分子量や式量を計算できます。
このとき、物質量(mol)の概念を理解しましょう。1molの物質が存在するとき、何gあるのかを表すのが原子量や分子量、式量です。モル質量を利用することによって、何gの化合物があるのか(または何molが存在するのか)がわかります。
また1molの物質がある場合、必ず6.0×1023個の原子または分子が存在します。気体の場合、標準状態では必ず22.4Lとなります。
物質量にはこうした性質があることを学びましょう。またモル質量を利用することにより、質量数や重さ、体積(気体の場合)を計算できるようになりましょう。






