酸・塩基による反応で最も有名なのは中和反応です。中和反応によって、酸と塩基から水が生成されます。また、同時に塩(えん)が発生します。
中和滴定をするとき、実験器具と指示薬を利用することになります。それぞれの器具や指示薬がどのような役割をもっているのか理解しなければいけません。
また中和滴定をするとき、場合によっては一回の中和反応で終わらないことがあります。このとき、少し内容が特殊な中和滴定として二段階滴定(二段階中和)や逆滴定があります。これら中和反応の方法を学ぶことによって溶液の濃度を知ることができます。
化学で中和滴定の問題が出されるとき、計算問題を解くことになります。そこで、中和滴定による溶液濃度の計算を行えるようになりましょう。
もくじ
pHの概念:酸性・中性・塩基性の判断
中和滴定を学ぶとき、事前に必ず理解しなければいけないのがpH(ピーエイチ)です。pHは多くの場面で利用される言葉でもあるため、既に概念を理解している人はたくさんいるかもしれません。
水中に存在するH+とOH–の濃度について、2つの濃度をかけ算すると必ず以下の関係になることが知られています。
- [H+][OH–]=1.0×10-14 (mol/L)2
つまり、H+とOH–の濃度をかけると1.0×10-14 (mol/L)2になります。このとき、pHというのは、H+の濃度に対して、log10を利用してマイナスを加えるときの値になります。
例えばH+の濃度が1.0×10-1 mol/Lの場合、pHは1です。
\(-log_{10}1.0×10^{-1}=1\)
またH+の濃度が1.0×10-13 mol/Lの場合、pHは13です。
\(-log_{10}1.0×10^{-13}=13\)
このとき、pHの値が小さいほど酸性が強いことを意味します。一方でpHが7の場合、H+とOH–の数が同じです。前述の通り、H+とOH–の濃度をかけると1.0×10-14 (mol/L)2になるからです。
\(1.0×10^{-7}×1.0×10^{-7}=1.0×10^{-14}\)
またpHが7を超えると塩基性となります。
いずれにしても、pHの値は0~14になります。pH7が中性であり、pHが0に近いと酸性が強くなり、pHが14に近いと塩基性が強くなります。中和滴定を学ぶとき、pHの概念を理解しておくことは必須です。
中和滴定と中和滴定曲線の関係
なお中和滴定では、逆の性質をもつ溶液を加えます。濃度がわかっている溶液を加えることにより、中和させる方法を中和滴定といいます。中和滴定をすることによって、濃度未知の水溶液の濃度がわかります。
例えば濃度未知の酸性水溶液を中和滴定したい場合、濃度が既にわかっている塩基性水溶液を用意します。
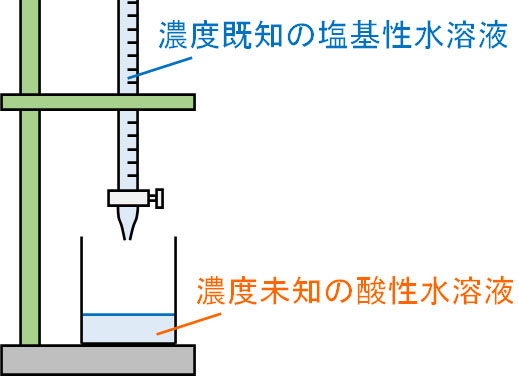
塩基性水溶液は既に濃度がわかっているため、いくらの量を加えることによって中和が完了したのか調べれば、酸性水溶液の濃度を知ることができます。
なお中和滴定曲線を確認すると、中性の周辺(pH7の周辺)では急激にpHが変化します。これをpHジャンプといいます。例えば強酸性溶液に対して強塩基性水溶液を加える場合、中性付近では以下のようにpHが変化します。
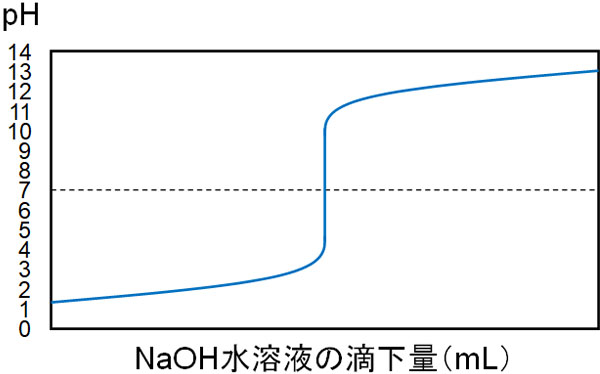
なぜ、pHジャンプが起こるのでしょうか。これについて、実際に計算してみればわかります。
例えば1.0mol/Lの酸性溶液10mLに対して、1.0mol/Lの塩基性溶液を利用して中和滴定をする場合、当然ながら10mLの塩基性溶液を加えると中性になります。中性なのでpHは7です。
一方、10mLではなく9mLの塩基性溶液を加えるときのpHはどのようになるでしょうか。水溶液に存在するH+の濃度は以下のようになります。
\(1×\displaystyle\frac{10}{1000}-1×\displaystyle\frac{9}{1000}=0.001\)
こうして、塩基性溶液を9mL加えた後は0.001molのH+が水溶液に存在することになります。全体では19mL(0.019L)になっているため、モル濃度は以下のようになります。
\(0.001:0.019=x:1\)
\(0.019x=0.001\)
\(x≒0.0526\)
そこでpHを計算すると約1.28になります。
\(-log_{10}0.0526≒1.28\)
つまり、1mLの塩基性水溶液を加えるとpH1.28からpH7へ急上昇します。実際に計算すると、なぜpH7の周辺で値が急激に変化するのかわかります。
実験器具を利用し、中和滴定を完了する
それでは、中和滴定をするときの実験器具と指示薬を学びましょう。中和滴定の実験器具としては、以下の2つを利用します。
- ホールピペット
- ビュレット
中和滴定をするとき、正確な量の水溶液を取り出さなければいけません。そこで正確な量の溶液を取り出すため、ホールピペットを利用します。ホールピペットには目盛りが1つあり、ホールピペットの大きさによって10mLの水溶液を得ることができたり、20mLの水溶液を得ることができたりします。
ホールピペットを利用するとき、口で吸い上げることによって溶液を取り出します。勢いよく吸い上げると劇薬(水酸化ナトリウム水溶液、硫酸水溶液など)が口の中に入るため、ゆっくりと吸い上げなければいけません。
またホールピペットを利用して溶液を取り出した後、実際に溶液を滴下していくことになります。中和滴定で溶液を滴下するときに利用する以下の器具をビュレットといいます。
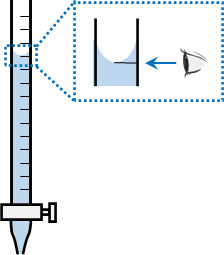
ビュレットの目盛りを確認するとき、必ずくぼんだ部分を見るようにしましょう。実験操作では、そのようにルールが決められています。
指示薬の種類:フェノールフタレインとメチルオレンジ
濃度がわかっている液体をビュレットから滴下することによって中和していきます。ただ溶液は透明であるため、いつ中和反応が完了したのかわかりません。そこで事前に指示薬を入れておきます。
pHによって色が変わる化学物質を指示薬といいます。有名な指示薬には以下があります。
- フェノールフタレイン
- メチルオレンジ
フェノールフタレインはpHが8.0~9.8のときに無色(酸性側)から赤色(塩基性側)へ変化します。一方、メチルオレンジはpHが3.1~4.4のときに赤色(酸性側)から黄色(塩基性側)へ変化します。
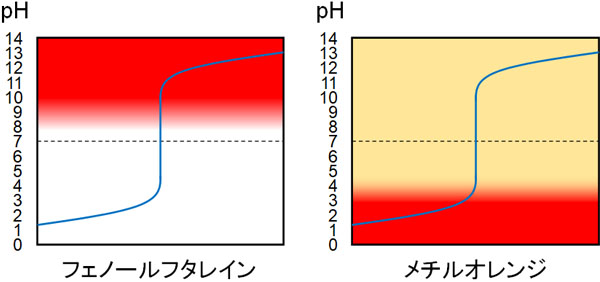
そこで、フェノールフタレインとメチルオレンジを使い分けましょう。
なおフェノールフタレインもメチルオレンジも、ぴったりpH7で色が変化するわけではありません。ただpHジャンプがあるため、pH7ではない場所で色が変わっても問題ありません。要は、pH7でなくても誤差範囲内と考えることができるのです。
・強酸と強塩基の中和滴定
強酸と強塩基は電離度が高いため、水溶液中で完全にイオンの状態になっています。そのためpHジャンプの度合いが大きく、フェノールフタレインでもメチルオレンジでも利用できます。
なお一般的には無色から有色(または有色から有色)になるほうがわかりやすいです。そのため「強酸+強塩基」の条件で塩基性溶液を滴下する場合、フェノールフタレインを利用します。一方で酸性溶液を滴下する場合、メチルオレンジを利用します。
・強酸と弱塩基の中和滴定
一方で強酸と弱塩基の中和滴定では、最適な指示薬を選ばなければいけません。強酸と弱塩基を反応させる場合、塩は酸性を示します。例えば塩酸とアンモニアを反応させると塩化アンモニウム(NH4Cl)を生じ、塩化アンモニウムは酸性を示します。
つまり中和滴定をすると、酸性物質の塩として生成されるため、中和点はpH7より低くなり、酸性側に偏ります。そのため強酸と弱塩基による中和滴定でフェノールフタレインは適さず、メチルオレンジを利用するのが正しい選択になります。
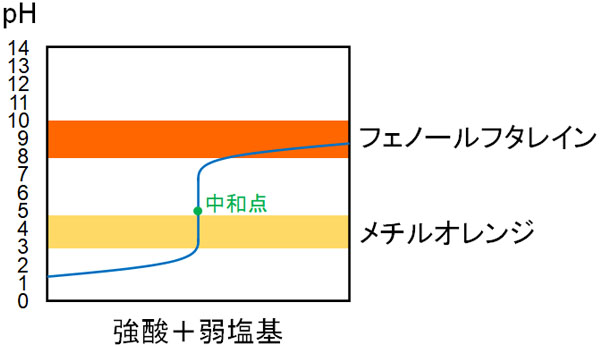
・弱酸と強塩基の中和滴定
一方、弱酸と強塩基を反応させると、塩基性の塩を生じます。そのため、中和点は塩基性に傾きます。そのためメチルオレンジでは正しく中和点を判定できず、フェノールフタレインを利用するほうが最適です。
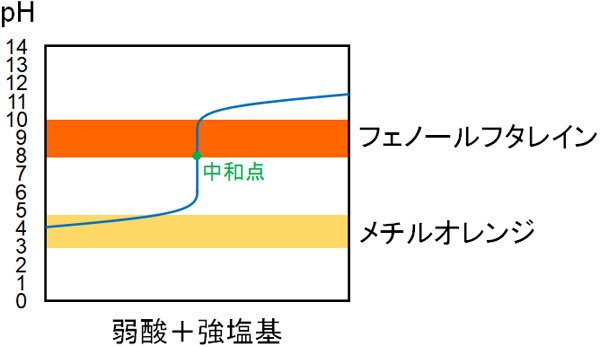
このように、どのような溶液を中和滴定するのかによって指示薬を使い分けましょう。なお弱酸と弱塩基の中和滴定をするケースは基本的にないため、中和滴定では3パターンの組み合わせを覚えましょう。
食酢に存在する酢酸の濃度を決定する手順:共洗いの必要性
それでは中和滴定を利用することによって、この中には食酢に存在する酢酸の濃度を決定するにはどのようにすればいいのでしょうか。食酢は私たちが日常生活でひんぱんに利用しており、酢酸が含まれています。そこで、酢酸の濃度を調べるのです。
酢酸は弱酸であるため、強塩基を利用して中和滴定をしましょう。このとき利用されるのが水酸化ナトリウム(NaOH)です。
水酸化ナトリウムは固体です。ただ水酸化ナトリウムは空気中の水分を取り込む性質があります。そのため水酸化ナトリウムの重さを測って水溶液を作っても、正確な濃度はわかりません。そこで酢酸の濃度を決定する前に「濃度がわかっているシュウ酸水溶液」を利用します。
シュウ酸二水和物は空気中で安定しており、正確な濃度の水溶液を作ることができます。そこでシュウ酸水溶液を利用し、水酸化ナトリウム水溶液の正確な濃度を調べます。
その後、濃度が判明した水酸化ナトリウム水溶液を利用し、食酢を中和滴定することによって、含まれている酢酸の濃度を調べるのです。これが、食酢に含まれる酢酸濃度を調べるときの手順です。
・器具名と操作を覚える
なお中和滴定をするとき、器具名を問われることがあります。そこで、以下の器具を覚えましょう。
- メスフラスコ:溶液を正確な体積になるように調節するための器具。
- ホールピペット:正確な体積の溶液を取り出す器具。
- ビュレット:液体を入れ、コニカルビーカーへ溶液を滴下させるための器具。
- コニカルビーカー:液体を入れる場所。ホールピペットからコニカルビーカーへ溶液を移し、ビュレットからの滴下を受ける。また、事前に指示薬を入れておく必要がある。
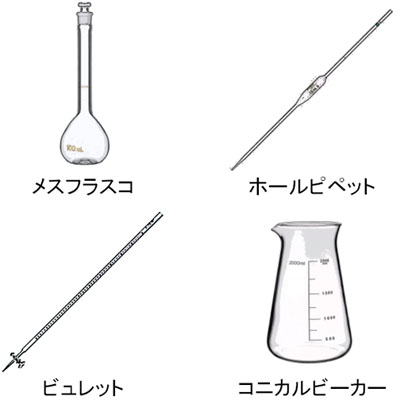
なお同じ器具を利用して異なる溶液を利用する場合、次に利用したい溶液を用いて、2~3回ほど器具内に軽く溶液を通します。これによって以前に使用していた溶液を洗い流し、次に利用したい溶液が器具内に残ることになります。この操作を共洗いといいます。
共洗いをしない場合、前の溶液が器具内に残っているため、正確なデータを得ることができません。そのため、共洗いが必要になります。
食酢の中和滴定によって濃度を決定する
それでは、中和滴定を行うことで濃度決定をしてみましょう。食酢に含まれる酸がすべて酢酸であるとき、以下の問題の答えは何でしょうか。
- ホールピペットを用いて0.10mol/Lのシュウ酸水溶液10.00mLを取り、コニカルビーカーに入れて指示薬を加えました。未知濃度の水酸化ナトリウム水溶液を作り、測定したところ、20.00mLを加えたときに変色しました。
- 次にホールピペットで食酢5.00mLを取り、メスフラスコを用いて100mLに希釈しました。この溶液をホールピペットで10mL取り、先ほどの水酸化ナトリウム水溶液を用いて測定したところ、3.00mLを加えたときに変色しました。希釈前の酢酸のモル濃度を求めましょう。
まず、水酸化ナトリウム水溶液のモル濃度を計算しましょう。シュウ酸(COOH)2は2価の酸です。また中和反応ではH+とOH-の数が一緒になる必要があるため、水酸化ナトリウム水溶液のモル濃度を\(x\)とすると以下の式を作ることができます。
\(0.1×2×\displaystyle\frac{10}{1000}=x×\displaystyle\frac{20}{1000}\)
\(x=0.1\)
こうして、水酸化ナトリウム水溶液のモル濃度は0.1mol/Lであるとわかります。
次に、薄めた後の酢酸のモル濃度を求めましょう。酢酸は1価の酸であるため、酢酸のモル濃度を\(y\)とすると、以下の式を作ることができます。
\(0.1×\displaystyle\frac{3}{1000}=y×\displaystyle\frac{10}{1000}\)
\(y=0.03\)
こうして、薄めた後の酢酸のモル濃度は0.03mol/Lとわかりました。なお、中和滴定で利用した酢酸水溶液は5mLから100mLへ薄めています。20分の1に薄めているため、20倍することで希釈前の食酢に含まれる酢酸のモル濃度を得ましょう。つまり、希釈前の酢酸のモル濃度は0.6mol/Lです。
炭酸ナトリウムを用いる二段階滴定(二段階中和)の方法
先ほどの計算は最も単純な中和滴定の方法です。次に、炭酸ナトリウム(Na2CO3)を用いる二段階滴定(二段階中和)のケースを考えましょう。
炭酸は弱酸であり、水酸化ナトリウムは強塩基です。そのため、炭酸ナトリウムは塩基性を示します。つまり炭酸ナトリウムは塩酸(HCl)などの酸と反応することで中和反応が起こります。
炭酸ナトリウムに対して塩酸を加えるとき、以下の2つの反応が起こります。
- Na2CO3 + HCl → NaHCO3 + NaCl
- NaHCO3 +HCl → H2CO3 + NaCl
重要なのは、最初の反応と二回目の反応が同時に起こらないことです。
炭酸ナトリウムを用いる二段階滴定では、最初の反応はフェノールフタレイン、二回目の反応はメチルオレンジを利用するのが最適です。以下のように中和反応が進むからです。
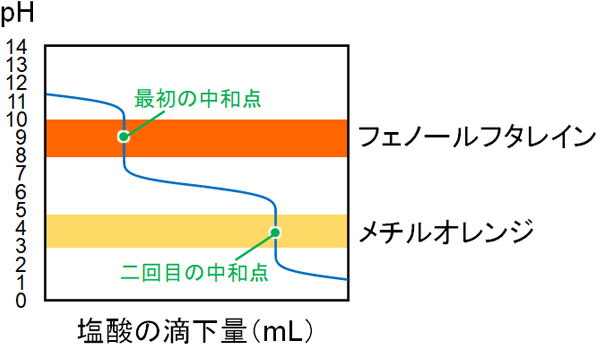
なお炭酸ナトリウムの物質量が\(x\)molの場合、中和完了に必要な塩酸の量は\(2x\)molです。また、生成する塩化ナトリウムは\(2x\)molです。
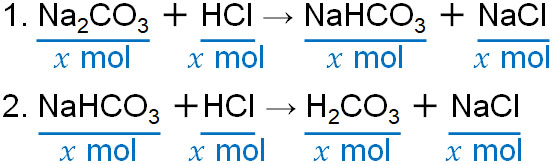
二段階滴定の計算問題を解く場合、この事実を理解していれば難しくありません。中和反応が2回起こることを理解して、二段階滴定での計算をしましょう。
逆滴定によって濃度未知の溶液の濃度を知る
ここまで解説した方法とは異なる中和滴定の方法に逆滴定があります。これまで学んできた内容では、濃度がわかっている溶液を少しずつ加え、中和が完了した時点で終了となります。言い換えると、H+とOH–の量が同じになった時点で中和反応が完了します。
一方、逆滴定では最初に濃度がわかっている溶液を過剰に加えます。例えば濃度未知の酸に対して、濃度が既にわかっている強塩基(水酸化ナトリウム水溶液など)を過剰に加えます。その後、濃度がわかっている酸(塩酸など)を少しずつ加えることにより、中和が完了した時点を終了とします。
それでは、どのような場面で逆滴定をすることになるのでしょうか。気体の物質量を調べたいとき、逆滴定が利用されます。例えばアンモニア(NH3)の物質量を調べるとき、過剰な塩酸(濃度既知)と反応させます。その後、濃度がわかっている水酸化ナトリウム水溶液を用いて中和滴定をします。
純水にアンモニアを吸収させてもいいですが、アンモニアは塩基性であるため、塩酸水溶液と反応させるほうが効果的です。そこで、逆滴定によって気体の物質量を計算するのです。例えば、以下の問題の答えは何でしょうか。
- 気体のアンモニアについて、0.1mol/Lの塩酸50mLに吸収させました。その後、0.2mol/Lの水酸化ナトリウム水溶液を用いて中和滴定すると、20mLを加えたときに中和が完了しました。気体のアンモニアの物質量はいくらでしょうか。
アンモニアの物質量を\(x\)としましょう。中和反応では、必ずH+とOH–の量が同じになります。そのため、以下の式を作りましょう。

塩酸は1価の酸であり、アンモニアと水酸化ナトリウムは1価の塩基です。そのため、この式によってH+とOH–の量が同じになります。また、この式を計算すると\(x=0.001\)です。こうして、気体のアンモニアが0.001mol存在していたことがわかります。
中和滴定の計算では、必ずH+とOH–の量が同じになります。このルールを守れば、逆滴定であっても計算問題は難しくありません。
中和滴定の実験操作を学び、計算できるようにする
酸と塩基の反応で学ぶのが中和滴定です。pHを利用することによって、酸性・中性・塩基性を判断するのです。
実際に中和滴定を行うとき、実験操作を覚えましょう。実験器具の名前については、覚えていないと答えを得ることができません。また、どのような手順によって中和滴定を行うのか理解しましょう。このとき利用する指示薬も重要です。
なお一般的な中和滴定だけでなく、二段階滴定や逆滴定という方法もあります。一般的な中和滴定とは方法が異なるため、どのように行う中和滴定なのか把握しましょう。ただ、H+とOH–の数を同じにするという基本的な考え方は共有しています。
中和滴定では計算問題が出され、複数の中和滴定の方法があります。ただ解き方は同じです。そこで実験操作を覚え、計算問題を解けるようになりましょう。