気体を学ぶとき、圧力を取り扱います。気体の圧力は分子ごとに分けることができます。すべての気体の圧力を全圧と呼ぶのに対して、分子ごとの圧力を分圧といいます。
空気のように、複数の気体が混ざっている場面はよくあります。そこで混合気体の計算をするとき、分圧を利用すると効果的です。
分圧の計算ではドルトンの分圧の法則を利用します。分圧というのは、足し算によって計算できます。また分圧は物質量に依存するため、モル分率を利用することによって分圧の計算が可能です。
それでは、どのように分圧の計算をすればいいのでしょうか。ここでは複数の気体が混ざっているときについて、圧力の計算方法を解説していきます。
もくじ
全圧と分圧の違い
気体の状態方程式を学ぶ場合、全圧を用いて計算します。例えば空気の圧力を計算するのは、全圧を計算するのと意味が同じです。すべての分子について、圧力を足した値が全圧です。
一方、分圧とは何でしょうか。空気であれば、窒素と酸素で主に構成されています。つまり大気圧(空気の圧力)というのは、窒素と酸素による圧力と考えることができます。
- 空気の圧力(全圧):窒素と酸素の両方による圧力
- 分圧:窒素の圧力、酸素の圧力
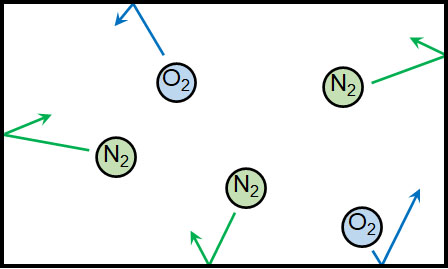
つまり、分子ごとの圧力が分圧です。空気の圧力について、窒素の圧力は分圧ですし、酸素の圧力も分圧です。
ドルトンの分圧の法則:圧力は足し算できる
重要なのは、分圧を分けて計算できることです。例えば窒素と酸素のみが存在する場合、以下の足し算によって全圧の計算ができます。
- 全圧 = 窒素の分圧 + 酸素の分圧
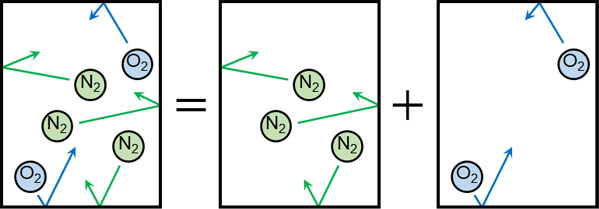
混合気体の圧力(全圧)というのは、それぞれの気体の圧力を足すことによって計算できます。これをドルトンの分圧の法則といいます。
例えば気体A(圧力はPA)、気体B(圧力はPB)、気体C(圧力はPC)が混ざっている場合、全圧Pは以下の計算式になります。
- \(P=P_A+P_B+P_C\)
なお、それぞれの圧力は体積Vや物質量n、温度Tがわかれば計算できます。そこでそれぞれの分圧を計算し、足すことによって全圧の計算が可能になるのです。
例えば、以下の問題の答えは何でしょうか。
- 8.3Lの容器に窒素2.0molと酸素1.0molが入っています。温度が27℃のとき、全圧(P)とそれぞれの気体の分圧(窒素:P1、酸素:P2)はいくらでしょうか。なお、気体定数Rを8.3×103Pa·L/(K·mol)とします。
気体の状態方程式を利用して問題を解くと以下のようになります。
・窒素の分圧
\(8.3P_1=2×8.3×10^3×300\)
\(P_1=6.0×10^5\)
・酸素の分圧
\(8.3P_2=1×8.3×10^3×300\)
\(P_2=3.0×10^5\)
・全圧
\(P=6.0×10^5+3.0×10^5\)
\(P=9.0×10^5\)
気体の状態方程式を利用して圧力を計算すればいいため、分圧の計算問題を解くのは難しくありません。
分圧には飽和蒸気圧も関係している
なお気体の圧力を学ぶとき、状態図(蒸気圧曲線)を利用する問題を解くことがよくあります。蒸気圧というのは、分圧と同じと理解しましょう。
窒素や酸素の場合、常温では常に気体です。一方、物質によっては温度によって自由に液体や気体になるケースがあります。この代表例が水です。
液体の水を密封容器に入れるとき、水分子は液体だけで存在しているわけではなく、気体(水蒸気)としても存在します。また密封容器に液体の水が存在する場合、必ず気体平衡となっており、水は液体になったり気体になったりしています。
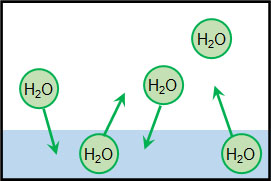
容器について、外側からは空気(窒素と酸素)が容器を押しています。一方で容器の内側からは、空気(窒素と酸素)による圧力だけでなく、水蒸気(気体の水)による分圧も発生しています。気体の水についても、壁に衝突することで圧力を生じるのです。
飽和蒸気圧の計算をするというのは、言い換えると水蒸気(気体の水)の分圧を計算するのと意味が同じです。すべての気体の圧力というのは、蒸気圧も含めて計算するようにしましょう。例えば、以下の問題の答えは何でしょうか。
- ある気体を水上置換で集めました。容器と水槽で水位を合わせ、容器内の体積を測定すると8.3Lでした。大気圧が9.96×104Paであり、27℃での水の飽和蒸気圧を3.6×103Paとします。気体定数Rが8.3×103Pa·L/(K·mol)であり、27℃で測定している場合、気体の分圧と物質量はいくらでしょうか。
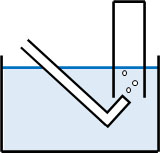
気体を水上置換で集めているというのは、要は密封容器に水が存在している状態と同じと考えましょう。つまり、密封容器に水(液体)と発生させた気体が存在しています。

また液体の水が存在するため、一部は蒸気(気体の水)で存在しています。そのため発生した気体の分圧と水蒸気の分圧(気体の水の圧力)を足すと、容器内の気体の圧力になります。容器内の圧力は大気圧と釣り合っているため、求める気体の分圧をPとして以下の式を作りましょう。
\(9.96×10^4=P+3.6×10^3\)
\(P=9.6×10^4\)
こうして、気体の分圧は9.6×104Paとわかりました。
気体の分圧がわかれば、気体の物質量の計算が可能です。容器の体積は8.3L、温度は300Kであるため、気体の状態方程式に値を代入することで物質量(n)を計算しましょう。
\(9.6×10^4×8.3=n×8.3×10^3×300\)
\(n=0.32\)
こうして、気体の物質量は0.32molとわかります。
圧力は物質量に依存し、モル分率による計算が可能
次に、物質量を利用することによって圧力を計算しましょう。圧力を生じる理由は、気体が壁に衝突するからです。つまり分子が壁に衝突する回数が多いほど圧力が大きくなります。
容器内に存在する気体の物質量が少ない場合、圧力は小さいです。また容器内に多くの分子が存在する場合、圧力は大きくなります。圧力の大小というのは、容器内に存在する分子の物質量に依存するのです。
つまり分圧というのは、どれだけ多くの分子が存在するのかによって決まります。より詳しくいうと、モル分率(モル濃度の比率)によって分圧の計算が可能です。
例えば圧力が9.0×104Paであり、窒素分子が2mol、酸素分子が1mol存在する場面を考えてみましょう。窒素分子と酸素分子の物質量の割合は2:1です。これはつまり、窒素と酸素の分圧が2:1であることを意味しています。
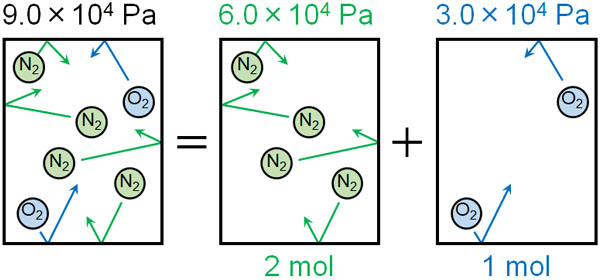
そのため全圧が9.0×104Paなのであれば、窒素の分圧は6.0×104Paであり、酸素の分圧は3.0×104Paです。気体の圧力は「分子がどれだけの割合で容器内に存在するのか」で決まるため、物質量の割合(モル分率)が重要になるのです。
・モル分率を利用して圧力を得る
なおモル分率がわかっているのであれば、モル分率を利用してほかの気体の分圧を計算することができます。モル濃度の割合に応じて分圧が決まるため、モル分率を利用することで圧力を得られるのです。
例えば窒素分子が3mol、酸素分子が1mol存在する場合、混合気体のモル分率は窒素が\(\displaystyle\frac{3}{4}\)、酸素が\(\displaystyle\frac{1}{4}\)です。つまり全圧に対して、窒素の分圧は\(\displaystyle\frac{3}{4}\)ですし、酸素の分圧は\(\displaystyle\frac{1}{4}\)です。
また窒素と酸素の割合は3:1であるため、窒素の分圧を\(\displaystyle\frac{1}{3}\)倍すれば、酸素の分圧を得ることができます。当然、酸素の分圧を3倍すれば窒素の分圧になります。分圧の計算では、分圧と物質量の比は同じになります。
圧力と物質量の関係を数式で表す
それでは、圧力と物質量の関係を数式で表してみましょう。全圧をP、分子Aの分圧をPA、分子Bの分圧をPBとします。また、分子Aの物質量をnA、分子Bの物質量をnBとします。圧力と物質量の比は同じなので、以下の関係が成り立ちます。
- \(P:P_A:P_B=(n_A+n_B):n_A:n_B\)
教科書では最初にこのような数式が提示されるため、理解しにくいです。ただここまでの内容を学び、圧力と物質量の比が同じであると理解すれば、数式の意味を把握するのは簡単です。
また物質量の割合(モル分率)を計算すると、分子Aは\(\displaystyle\frac{n_A}{n_A+n_B}\)であり、分子Bは\(\displaystyle\frac{n_B}{n_A+n_B}\)です。そのため全圧Pを利用して、以下のように分圧を計算できます。
- \(P_A=P×\displaystyle\frac{n_A}{n_A+n_B}\)
- \(P_B=P×\displaystyle\frac{n_B}{n_A+n_B}\)
これらの数式を覚える必要はありません。圧力と物質量の比が同じであることを理解すれば、ここまで解説した式を作れるようになります。
2気体が存在するとき、分圧の計算を行う
それでは、2気体が存在するときの分圧の計算をしてみましょう。以下の問題の答えは何でしょうか。
- コックが閉じた状態にて、9.0Lの容器Xに4.0×105Paの窒素、3.0Lの容器Yに4.0×105Paの酸素が入っています。温度を一定に保ってコックを開くとき、「それぞれの気体の分圧」と「窒素と酸素の物質量の割合」を計算しましょう。
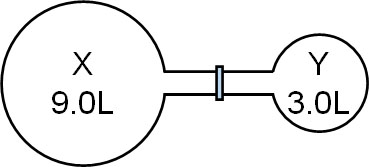
コックを開ける場合、変化するのは容器の体積です。温度は一定であるため、窒素の分圧をPA、酸素の分圧をPBとすると、ボイルの法則を利用して以下のように分圧を計算できます。
・PAの計算
\(4.0×10^5×9=P_A×12\)
\(P_A=3.0×10^5\)
窒素の分圧は3.0×105Paと計算できます。
・PBの計算
\(4.0×10^5×3=P_B×12\)
\(P_B=1.0×10^5\)
酸素の分圧はと1.0×105Paと計算できます。
・窒素と酸素の物質量の割合
なお、分圧の割合は物質量の割合と同じになります。そのため窒素の物質量をnA、酸素の物質量をnBとしたとき、窒素と酸素の物質量の割合は以下のように計算できます。
\(n_A:n_B=3.0×10^5:1.0×10^5=3:1\)
分圧の性質を利用して計算する
複数の気体が混ざっていることはよくあります。混合気体について、すべての分圧を足すと全圧になります。
ドルトンの分圧の法則を利用して分圧や全圧の計算をしましょう。分子ごとに圧力を計算し、足せばいいとわかれば、分圧や全圧の概念は難しくありません。なお分圧には飽和蒸気圧も関わるため、液体(水など)が気体になるときの圧力を計算できるようになりましょう。
また気体の分圧は物質量に依存します。物質量が多いほど、分圧も大きくなります。分圧と物質量の比率は同じであるため、モル分率を利用することによって分圧や全圧の計算が可能です。
分圧の性質を理解すれば、新たな公式を覚えなくても計算問題を解けるようになります。分圧の性質を利用して、そのつど計算式を作れるようになりましょう。






