C=Oの構造をもつ化合物がカルボニル化合物であり、カルボニル化合物は非常に種類が多いです。これらカルボニル化合物の中でも、カルボン酸から合成できるカルボニル化合物をカルボン酸誘導体といいます。
カルボン酸誘導体としては、塩化アシルや酸無水物、エステル、アミドなどと種類があります。それぞれ反応性や安定性が異なるため、合成反応の内容は違います。
ただ、それぞれのカルボン酸誘導体について反応性を理解すれば、どのような化合物を合成できるのか把握できるようになります。カルボン酸誘導体では求核アシル置換反応がメインであり、どのような合成反応になるのか予測できます。
そこで、カルボン酸誘導体を利用してどのように合成反応を進めればいいのか、反応機構を含めて解説していきます。
もくじ
カルボニル化合物への求核アシル置換反応
有機化学では、官能基ごとに特徴的な合成反応が存在します。特に脱離基をもつカルボニル化合物であれば、求核アシル置換反応が起こります。
C=Oがアルキル鎖に結合している場合、アシル基といいます。アシル基にはカルボニル基やホルミル基など、多くの官能基が含まれています。要は、アルキル鎖の分子構造中にC=Oがあればアシル基だと理解すればいいです。
カルボニル化合物の中でも、脱離基をもつ分子がいくつかあります。これらをカルボン酸誘導体と呼び、具体的なカルボン酸誘導体は以下になります。
- カルボン酸
- エステル
- アミド
- ハロゲン化アシル
- 酸無水物
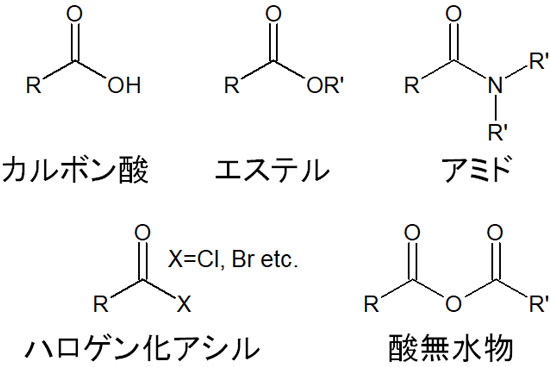
これらの化合物はすべて、カルボン酸を原料にして合成可能です。
またすべてのカルボン酸誘導体には脱離基があります。そのため求核剤がカルボニル炭素を攻撃することで、置換反応が起こります。アシル基に求核置換反応が起こるため、求核アシル置換反応といいます。反応機構は以下の通りです。
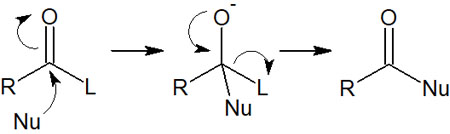
このように求核剤(Nu)が攻撃することで、脱離基(L)が離れていきます。その結果、新たな化合物を得られます。
脱離基が存在しない場合、求核付加反応になる
注意点として、カルボニル化合物の中には脱離基が存在しないことがよくあります。カルボニル基(ケトン)やホルミル基(アルデヒド)がこの例に該当します。
この場合は脱離基が存在しないため、求核アシル置換反応は起こりません。その代わりとして、求核付加反応が起こります。求核付加反応は以下のような反応機構になります。
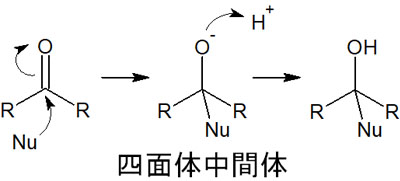
このように、反応後はアシル基が消えます。アシル基に対する求核攻撃が起こるにしても、脱離基が存在しない場合は異なる合成反応が進行することを理解しましょう。
求核置換反応(SN1反応とSN2反応)とは反応機構が異なる
なお求核剤を用いた合成反応としては、SN1反応やSN2反応などの求核置換反応が知られています。ただ、求核置換反応(SN1反応とSN2反応)と求核アシル置換反応は反応機構が異なります。
アシル基では、炭素原子に酸素原子が結合しています。しかもC=Oは二重結合で結合しているため、以下のように電子が動きます。
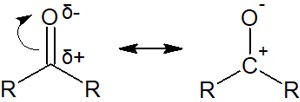
これはつまり、求核試薬がカルボニル炭素を攻撃するとき、必ず電子が酸素原子に移動することを意味しています。アシル基へ求核攻撃が起こるとき、すべての合成反応でカルボニル炭素が攻撃され、その後に電子が酸素原子に移動すると理解しましょう。
そのためSN1反応のように、脱離基が最初に離脱し、カルボカチオンが生成することはありません。またSN2反応のように、求核剤が攻撃すると同時に脱離基が脱離することはありません。つまり、以下の反応は起こりません。
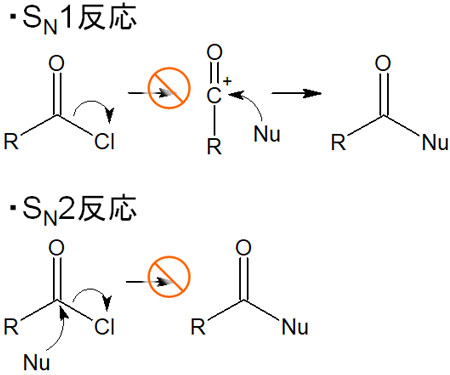
同じ求核試薬を用いた合成反応ではあっても、反応機構は異なります。アシル基が存在するかどうかによって、電子の流れは変わります。
安定性(脱離能)はカルボニル化合物の形で異なる
それでは、カルボン酸誘導体を学ぶときに重要なことは何なのでしょうか。カルボン酸誘導体には、反応性の順番があります。この順番を学ぶのがカルボン酸誘導体で最も重要です。
カルボン酸誘導体の反応性は以下の順番になっています。
・反応性の順番
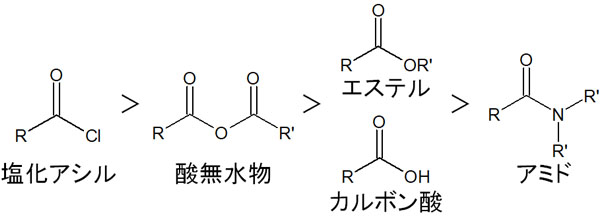
つまり塩化アシルは安定性が低く、最も反応性が高くなっています。一方でアミドでは、反応性が非常に低いです。参考までに、エステルの反応性はカルボン酸と同等です。
なぜ、このように反応性(または安定性)の順番が異なるのでしょうか。この理由の一つに共鳴構造式があります。例えば塩化アシルの場合、塩素原子は二重結合を作る性質が弱いです。そのため、共鳴構造の寄与が弱いです。
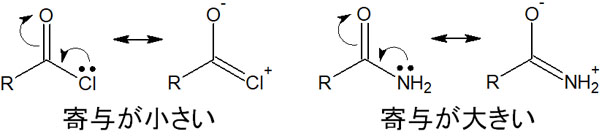
一方でアミドであれば、窒素原子は電子を押し出すことで二重結合を作れます。共鳴構造の寄与が大きく、電子の非局在化によって分子は安定します。
このような違いにより、同じカルボン酸誘導体であっても反応性や安定性が異なります。
反応性を安定性の順番で考える
これらの安定性を理解することがなぜ重要なのでしょうか。それは、化合物を反応させるときにどのような生成物を得られるのか理解できるからです。
例えば、サリチル酸と酸無水物を反応させたとき、以下のうちどちらの化合物を得られるでしょうか。
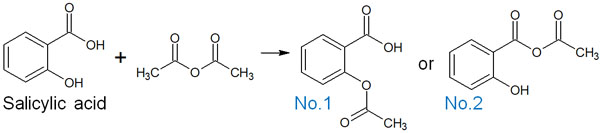
答えをいうと、No.2の化合物は得られません。No.1の化合物が合成されます。酸無水物と比べて、エステルは安定性が高いです。そのためエステル基をもつNo.1の化合物のみ得られます。No.2は酸無水物が構造式に存在するため、合成反応は進行しません。
化合物の合成反応では、通常は不安定な状態から安定な状態になるように反応が進行します。そのため今回の反応では、エステル基を有する化合物のみ得られます。
もちろん、カルボン酸から塩化アシルや酸無水物など、反応性の高い化合物を合成することは可能です。ただ特別な試薬を用いるなど、特殊な反応条件でのみ塩化アシルや酸無水物を合成できます。
カルボン酸誘導体ごとの反応性
それでは、カルボン酸誘導体を反応させるときの反応機構はどのようになっているのでしょうか。前述の通り、カルボン酸誘導体には種類があります。おさらいすると、反応性の順番は高い順に以下になります。
- 塩化アシル
- 酸無水物
- エステル&カルボン酸
- アミド
これらのカルボニル化合物について、どのように合成反応するのか解説していきます。
塩化アシルはほとんどの化合物と反応する
カルボン酸誘導体の中でも、非常に有益な化合物が塩化アシルです。なぜ塩化アシルが重要なのかというと、ほとんどの化合物と反応するからです。
塩化アシルはカルボン酸と反応し、酸無水物を合成できます。またアルコールと反応すれば、エステルを得られます。また水と反応すれば、カルボン酸になります。反応速度は非常に早く、反応試薬を入れた瞬間に生成物を得られます。

水を含め、非常に求核性の弱い試薬とも反応するため、塩化アシルを作った後はあらゆる化合物で合成反応を進行させることができます。
・塩化アシルを合成し、カルボン酸を活性化する
それでは、反応性の高い塩化アシルをどのようにして合成するのでしょうか。塩化アシルの合成では、通常はカルボン酸と反応させます。カルボン酸と反応させる試薬としては、例えば塩化チオニル(SOCl2)が知られています。
カルボン酸のOHは脱離能が低いです。そこで塩化チオニルを加えることで、カルボン酸を活性化させます。反応機構は以下のようになります。
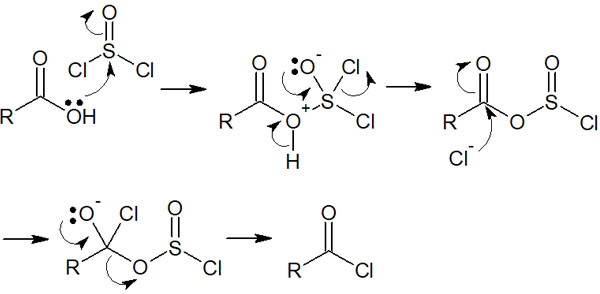
塩化アシルを合成した後、試薬(求核剤)を加えることですぐに次の合成反応を進める必要があります。前述の通り、塩化アシルは水と反応することでカルボン酸になります。塩化アシル化合物を単離するのは困難なため、塩化アシルを得たあとはすぐに次の合成反応を進めるのが一般的です。
酸無水物は安定性が低く、多くの化合物と反応する
塩化アシルほど安定性が低いわけではないものの、同様に反応性が高く、非常に多くの化合物と反応するのが酸無水物です。
酸無水物であれば、水やアルコールなど電荷をもたない求核性の低い化合物であっても合成反応が進行します。理由は既に述べた通り、より安定性の高いエステルやカルボン酸が生成されるからです。
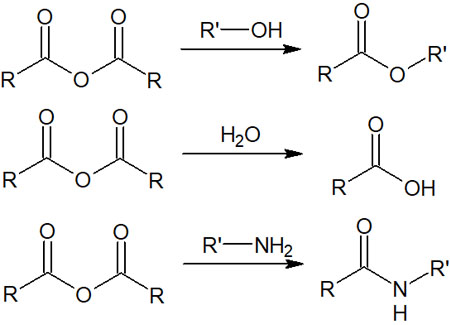
アミンは求核性が高いため、当然ながら酸無水物と反応し、アミドが得られます。ただ、求核性の高くない水とも反応することを理解しましょう。
塩化アシルの反応を理解すれば、酸無水物の反応機構を理解するのは簡単です。脱離基がCl–ではなく、COORに置き換わったのが酸無水物の求核アシル置換反応です。
エステルの反応機構と保護基
COOの構造をもつのがエステルです。エステルの合成反応で重要なのは加水分解です。塩基性または酸性の条件で反応させることで加水分解され、カルボン酸が合成されます。特に塩基性で加水分解する場合、けん化といいます。
塩基性条件で加水分解する場合、カルボン酸が生成された後、塩基によってプロトンが引き抜かれてカルボン酸はマイナスの電荷を帯びます。そのため、けん化は不可逆反応です。

一方で、酸性条件下で加水分解する場合、可逆反応になります。カルボン酸が生成しても、酸性条件であれば、カルボン酸はマイナスの電荷を帯びることはありません。
水と反応することで、酸性条件でエステルは以下のように加水分解されます。
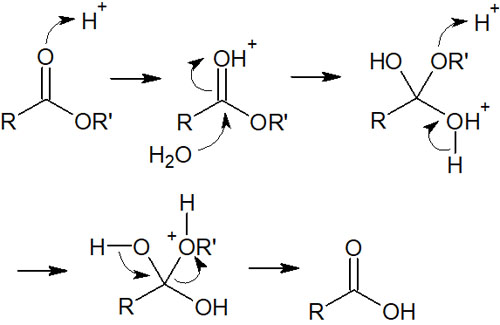
いずれにしても、エステルは加水分解によってカルボン酸になると理解しましょう。
・保護基で重要なエステル
カルボン酸誘導体の中でも、エステルは保護基として非常に重要な役割をします。カルボン酸から、エステルを容易に合成できます。それだけでなく、エステルからカルボン酸への加水分解も容易です。
カルボン酸とアルコール(ヒドロキシ基:-OH)が結合することで、エステルを合成することができます。そのため分子内にカルボン酸またはヒドロキシ基がある場合、事前にエステル保護しておくといいです。
特にカルボン酸は酸性の化合物であり、合成によって副生成物を生じやすく、合成後の精製も難しいです。そこで事前にエステル化させておき、必要なときに加水分解(脱保護)をすることで、目的化合物を得やすくすることはよくあります。
・エステル交換で他のエステルを生じる
なお、水と反応させることで加水分解&脱保護が可能であると説明しました。このとき反応させる試薬が水ではなく、他のアルコールだと、エステル交換を起こします。つまり、エステルが別のアルコールに置き換わるのです。
酸性条件では、前述の通りエステルの反応は可逆反応です。水を加えればカルボン酸になるが、他のアルコールと反応させると、異なるエステルを得られます。
例えば、メチルエステルの化合物とアルコールを混ぜ、高温で反応させます。エステル交換後に生成するメタノールの沸点は低いため、高温条件でメタノールはすぐに蒸発します。
一方で沸点の高いアルコールが存在する場合、メタノールのようにすぐには蒸発しません。例えばメタノールの沸点は65℃ですが、1-ブタノールの沸点は118℃です。そこでメチルエステル化合物と1-ブタノールを混ぜ、65℃付近で熱すれば、ブタノール由来のエステルに置き換わります。
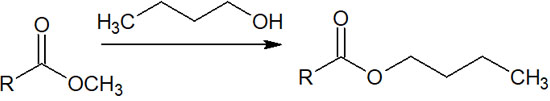
このようにして、酸性条件下でエステル交換による合成反応が可能です。生成されるアルコールを除去しつつ、エステル交換させたいアルコールと反応させることで、目的化合物を得られます。
酸性条件により、カルボン酸からエステルを合成する
またカルボン酸誘導体では、カルボン酸自体の反応条件を理解しなければいけません。カルボン酸誘導体の場合、さまざまな求核剤と反応します。一方でカルボン酸の場合、求核剤と反応しないことに注意しましょう。
通常、塩基性が強いほど求核性が高くなります。つまり、求核剤の多くは塩基だといえます。グリニャール試薬やアミンなど、これら求核性の高い化合物は塩基性を示します。
塩基性の物質とカルボン酸を混ぜると、求核攻撃による合成反応ではなく、酸塩基反応が優先的に起こります。以下のように、カルボン酸の水素原子が塩基によって引き抜かれるのです。
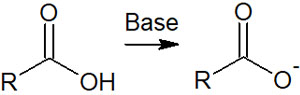
そのため求核剤を用いた合成反応をすることはできません。そこで塩基性ではなく、酸性条件にて合成反応を進めます。
酸性条件では、カルボン酸をエステル化することができます。カルボン酸とアルコールを混ぜ、反応させることでエステル化合物を得られます。反応機構については、酸性条件でのエステルのカルボン酸合成と逆になります。
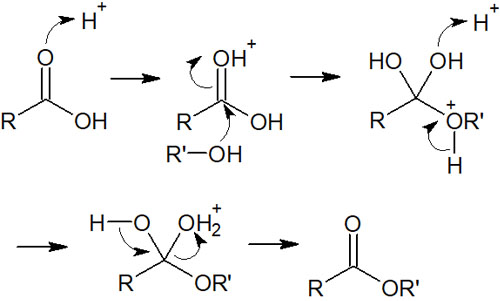
エステルの加水分解は可逆反応だと説明しました。そのため、同じようにカルボン酸からエステルを合成することができます。
アミドは酸で活性化させ、加水分解できる
カルボン酸誘導体の中でも、安定な化合物がアミドです。アミドの場合、脱離基はアミノ基になります。ただアミノ基は非常に強い塩基性化合物であり、通常は脱離基になりません。アミンと反応させてアミドを合成することはできても、アミンから他の化合物を得るのは困難なのです。
ただ、酸性条件下であればアミドを活性化させ、加水分解することができます。
アミドが-NH2や-NHR、-NR2の状態で脱離基になることはありません。一方、酸触媒を加えることで-NH3+や-NH2R+、-NHR2+の状態にすれば、アミドが活性化されます。プラスの電荷を帯びることで、脱離基になるのです。
そこで、酸性条件下で水またはアルコールを加えることで、アミドからカルボン酸またはエステルを合成できます。
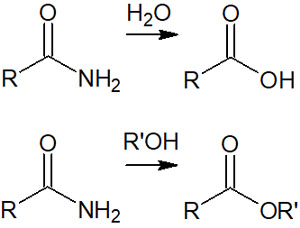
詳細な反応機構は以下の通りです。
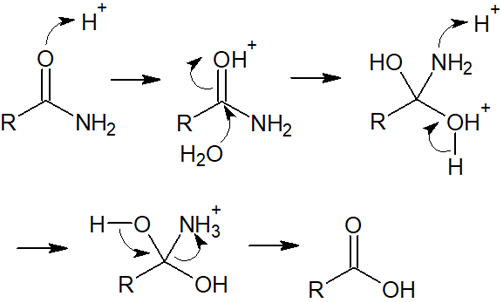
エステルやカルボン酸の反応機構とほぼ同じなので、アミドの加水分解の反応機構は簡単です。重要なのは、窒素原子にH+(プロトン)が結合することで、アミンがプラスの電荷を帯びることです。
塩酸や硫酸などの酸触媒が存在するからこそ、アミドの加水分解が進みます。この点については、カルボン酸との合成反応と共通しているといえます。
カルボン酸化合物ごとの特徴を理解する
非常に重要な置換基がC=Oです。ただC=Oの構造をもっている化合物であったとしても、官能基によって合成反応の種類が大きく異なります。
C=O構造を持つ化合物の中でも、カルボン酸誘導体の性質について解説してきました。アシル基を有するのがカルボン酸誘導体であり、どのような原子が結合しているのかによって反応性の順番が異なります。
カルボン酸誘導体で重要な化合物としては、塩化アシルや酸無水物、エステル、アミドなどがあります。反応機構はどれも似ています。しかし、反応条件や生成可能な化合物は違います。そこで、どのような反応条件で合成が進むのか理解しましょう。
有機化学の研究室では、求核アシル置換反応は頻繁に利用される合成反応です。そのため、反応性や反応機構を事前に理解しておく必要があります。






