有機化学で重要な反応機構の一つにラジカル反応があります。非常に反応性の高い中間体がラジカルであり、ラジカル反応を利用することで新たな結合を作ることができます。
酸と塩基による一般的な有機合成反応とは異なる反応機構がラジカル反応です。性質が異なる新たなことを学ぶため、ラジカル反応がどのような反応なのか多くの人にとって理解しにくいです。
ただ、ラジカル反応が起こる条件は決まっています。また、ハロゲンや過酸など、ラジカルを生じさせる物質は決まっています。さらにいうと、ラジカル反応の種類は共通です。そのため、どのようなときにラジカル反応が起こるのか学べば、ラジカル反応を理解できるようになります。
ここではラジカル反応の基礎を分かりやすく解説することで、どのようにラジカル反応が進行し、生成物を得られるのか確認していきます。
もくじ
ヘテロリシス(イオン)とホモリシス(ラジカル)の違い
一般的な有機化学の合成反応ではイオンの動きに着目します。酸と塩基の関係によって電子が動き、これによって合成反応が起こります。
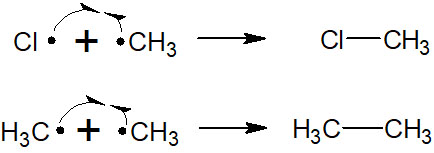
電子が動くとき、ほとんどのケースで2つの電子が移動します。こうした電子の移動をヘテロリシスといいます。ヘテロリシスが起こることで、イオンが生成されます。
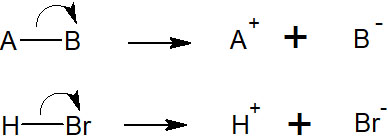
イオンを作ることで、化合物はプラスまたはマイナスの電荷を帯びるようになります。いわゆる酸と塩基の関係であり、ほとんどの合成反応でヘテロリシスが関与しているといえます。
一方でラジカル反応では、ホモリシスと呼ばれる現象が起こります。結合が切れるとき、2つの電子が移動することでイオンを形成するのではありません。電子が1つずつそれぞれの原子に移動するように結合が開裂することで、ラジカルを生じます。
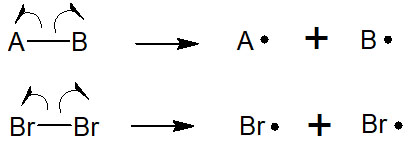
ラジカル反応では、最初に必ずホモリシスが起こります。多くの合成反応が酸と塩基によって進行するのと同じように、ラジカル反応もラジカル生成から反応がスタートします。そのため、ホモリシスが起こらなければラジカル反応は発生しません。
反応性が高く、異なる化合物を得られるラジカル
有機化合物の中間体の中でも、ラジカルは非常に反応性が高いことで知られています。電子が2つではなく1つの状態なので、その他の化合物と容易に化学反応を起こすのです。
また、ヘテロリシスによって生成するイオンと比較して、ホモリシスによって生じるラジカルは異なる生成物を得ることができます。例えば臭化水素の付加反応をするとき、酸・塩基の反応とラジカル反応では以下のように生成物が異なります。
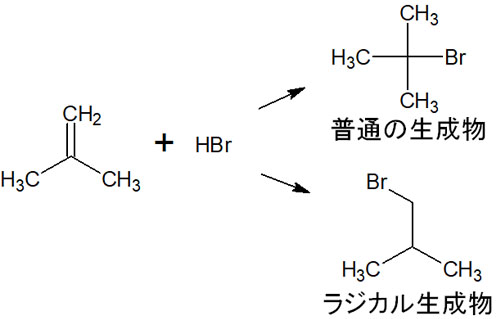
反応条件が違えば、得られる化合物は変わります。有機化学でラジカル反応が重要なのは、イオンによる反応とは異なる生成物を得られるからです。
それでは、なぜ先ほどのような生成物の違いがあるのでしょうか。アルケンに対する臭化水素の付加反応では、カルボカチオンが生成されることで合成反応が進みます。
一方で同じアルケンに対して臭化水素を反応させるにしても、酸素または過酸化物が存在する場合、ラジカル生成物を合成できます。ラジカル反応では主に過酸を利用します。過酸がホモリシスを起こすことでラジカルを作り、ラジカル生成物を得られるようになります。
・ラジカルを得る条件
なお、どのようなときにラジカルが生まれるのでしょうか。200℃以上の高温条件では、ほとんどのケースでホモリシスが起こり、ラジカルが生成されます。高いエネルギーを加えることで、ラジカルが生まれるのです。
ただ、室温より少し高い温度であったとしてもラジカルを生じるケースがあります。弱い結合を有する化合物では、結合が切れることでラジカルが生まれます。ラジカル反応では主に過酸を利用すると述べましたが、過酸は容易にラジカルを生成することで知られています。
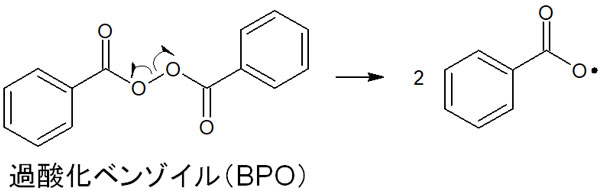
有名な過酸としては、過酸化水素が知られています。これら過酸の中でも、過酸化ベンゾイル(BPO)はラジカルの開始剤として頻繁に利用されます。酸素同士の結合が弱く、簡単にラジカルを生じるからです。
また塩素(Cl2)や臭素(Br2)などのハロゲンもラジカル反応の例として頻繁に出されます。ハロゲンに熱または光(紫外線・UV)を与えることで、結合が開裂してラジカルが作られます。

ハロゲン同士の結合についても弱いことで知られています。そのため塩素や臭素などのハロゲンが存在する場合、ラジカルが生まれます。
ラジカル反応の種類を把握する
それでは、ラジカル反応としてはどのような種類があるのでしょうか。ホモリシスについては、既に説明しました。すべてのラジカル反応では最初、ホモリシスが起こります。ホモリシスが起こるからこそ、ラジカル反応が進行するのです。
またホモリシスの逆もあります。ラジカル同士が反応し、結合を形成することをラジカルカップリングといいます。以下のような反応がラジカルカップリングです。
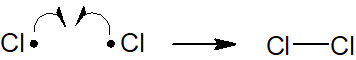
ラジカル反応の中でも、ホモリシスとラジカルカップリングは理解しやすいです。ただラジカル反応では、他に3種類の反応を学ばなければいけません。以下のラジカル反応です。
- ラジカルの水素引き抜き
- 二重結合へのラジカル付加
- β開裂でのアルケン生成
これらの反応機構を学ぶことで、ラジカル反応がどのように起こるのか理解できるようになります。
ラジカル引き抜きで水素の引き抜きが起こる
ラジカルに特徴的な反応として、水素原子の引き抜きがあります。要は、ラジカルがあると水素原子が引き抜かれ、新たなラジカルが生成されます。
この反応はラジカル引き抜きや原子引き抜きと呼ばれています。原子引き抜きの中でも、特に重要なのが水素原子の引き抜きです。そのため、ラジカル引き抜きは水素引き抜きとも呼ばれます。
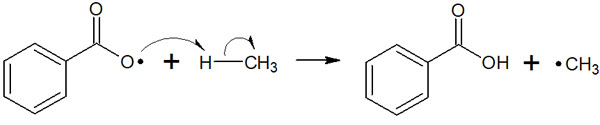
なぜ2つの呼び方があるのでしょうか。それは、水素だけでなく塩素や臭素などのハロゲン原子が引き抜かれることもあるからです。つまり、ラジカル引き抜きは水素引き抜きに限定されるわけではありません。
ただ、ハロゲンが存在しなければ水素引き抜きのみ発生します。そのため、ラジカル引き抜きでは水素引き抜きが最も重要です。
二重結合へのラジカル付加反応は重要
分子内に二重結合がある場合、ラジカルはアルケンと反応することで付加反応を起こします。二重結合へのラジカル付加反応で重要なのは、以下の2点です。
- 二重結合の末端部分と反応し、結合を作る
- 付加した場所の反対側に新たなラジカルが作られる
アルケンへの通常の付加反応だと、先ほどの臭化水素の例で述べた通り、多置換のアルカンが合成されます。一方でラジカル反応では、アルケンの末端部分とラジカルが反応することで新たな結合を作ります。
また付加反応を起こした後、反対側に新たなラジカルが生成されます。例えば、以下のようになります。
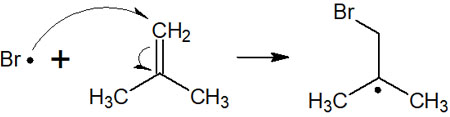
なお、ラジカルはなぜ末端の炭素原子を攻撃するのでしょうか。それは、ラジカル中間体の安定性が関与しています。
一般的な付加反応では、カルボカチオンの安定性が関与します。これと同じように、ラジカル中間体にも安定性に順番があります。以下のようになっています。
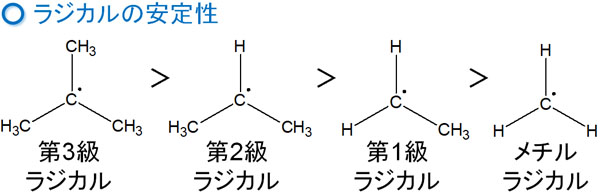
ラジカル反応後、反対側にラジカルが新たに生成されるとき、第三級ラジカルや第二級ラジカルだと安定になりやすいです。ラジカルは反応性が高い中間体であるものの、安定性に順番があるのです。そのため、二重結合へのラジカル付加反応では位置選択性があります。
先ほどの化合物の場合、ラジカル反応後に生成する中間体は第三級ラジカルです。このように考えて、合成される化合物を予測できます。
β開裂で新たな二重結合を作る
ラジカル反応では、二重結合を新たに作ることもあります。これをβ開裂といいます。先ほど、二重結合へのラジカル付加反応を説明しました。この逆の反応がβ開裂によるアルケンの生成です。
ハロゲンなどのように、「ラジカル反応を起こす原子」が炭素原子のβ位に結合している場合、ラジカル開裂を起こすことがあります。このときは二重結合を生成しつつ、ハロゲンにラジカルが移動します。反応機構は以下のようになります。
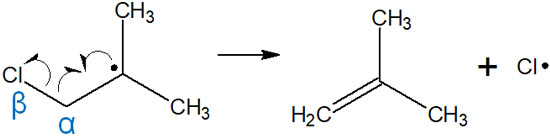
ラジカル反応では、β開裂によって二重結合を作ることもあります。今回の反応では、ラジカルは塩素原子に移ります。
ラジカル連鎖反応:開始段階と成長段階
このように、ラジカル反応にはいくつか種類があります。重要なのは、これらのラジカル反応が連鎖して起こることがあります。つまり、ホモリシスによってラジカルが生成することで、いくつものラジカル反応が進行していくのです。
ラジカル反応では、必ず以下の段階に分かれます。
- 開始段階
- 成長段階
- 停止段階
連鎖反応がどのような動きになっているのかについて、以下の簡単なラジカル反応にて解説していきます。
![]()
・開始段階でラジカル反応が始まる
塩素分子をラジカル反応で用いる場合、熱または光(紫外線:UV)を当てます。そうすると、ラジカルが発生します。すべてのラジカル反応はホモリシスによる開始段階が存在します。
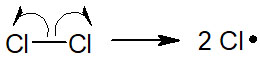
・成長段階で生成物を得る
ラジカルが生成した後、ラジカルが他の分子に攻撃することで、さらに反応が進行します。今回の反応では、塩素のラジカルは水素引き抜きによってメタンにラジカルを生成させることができます。以下のようになります。
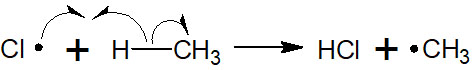
メチルラジカルを生じた後、今度はラジカルが塩素を攻撃します。このときの攻撃によって、目的化合物であるクロロメタンを得られます。
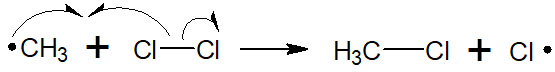
重要なのは、目的化合物を得た後であってもラジカルを生じていることです。このとき生成したラジカルが再びラジカル引き抜きを起こし、メチルラジカルを生じさせ、目的化合物を生成します。このように、一つの反応が起きた後に連続して反応するので連鎖反応と呼ばれます。
なお今回の反応では、ラジカルによる水素引き抜きが起こります。一方、例えばアルケンを反応させる場合、二重結合への付加反応が起こります。どのような試薬を用いて化合物を反応させるのかによって生成物は異なります。
停止段階(停止反応)で結合を作り、反応が止まる
それでは、連鎖反応は永久に起こるのでしょうか。もちろん、そういうわけではありません。ホモリシスが起こることで連鎖反応が発生するものの、どこかの段階で反応が止まります。これを停止段階(停止反応)といいます。
ラジカルは水素引き抜きや二重結合への付加、β開裂などを引き起こします。ただ、ラジカル同士が反応して新たな結合を作ることもよくあります。具体的には、ホモリシスの逆の反応が起こるのです。以下のような反応がこれに当たります。
これらの反応が起こると、ラジカルは消失します。新規にホモリシスを起こすことはないため、新たな結合を作って反応が完了します。ラジカル同士が結合を作り、停止段階によって連鎖反応がストップします。
厳密にいうと、空気中の酸素や水との反応もラジカルの停止反応です。ただこれら空気や水との反応は考慮せず、化合物同士のラジカル反応で停止段階を考えれば問題ありません。
・ラジカル反応の開始剤はある程度の量が必要
連鎖反応によって反応が進行するため、過酸化ベンゾイル(BPO)などの開始剤は少ない量であっても目的生成物を得ることができます。
ただ、開始剤の量が少なすぎても反応が進行しません。生成したラジカルの中には、前述の通りラジカル同士で新たな結合を作り、反応が停止することがあるからです。そのため開始剤の量は多すぎず、少なすぎない量が最適です。
アルキル鎖と反応させ、新たな結合を作る
それでは、これらラジカル反応をどのように有機化学で利用すればいいのでしょうか。ラジカル反応を用いた合成反応は、新たな結合を作るときに頻繁に利用されます。
例えば、アルカンとハロゲン(Cl2やBr2)を反応させることで、ハロゲンが付加された化合物を合成することができます。
また二重結合を有する化合物と反応させることで、新たな炭素の結合を作ることができます。有機化学で炭素鎖を作る方法はいくつかあります。その中の一つがラジカル反応です。例えば、以下の合成反応によって新たな炭素鎖を作れます。
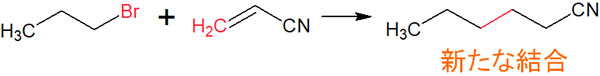
新たな結合を作りたいとき、ラジカル反応は有効です。炭素鎖にハロゲンを加えたり、炭素鎖を作ったりしたいとき、ラジカル反応を利用することができます。
・重合反応によってポリマーを得る
また連鎖反応によって反応が進んでいくため、反応試薬や化合物によっては重合反応を起こし、ポリマーを得られることはよくあります。炭素鎖が次々と作られることにより、ポリマーを生じるのです。
参考までに、熱や光(紫外線・UV)によってラジカルを生成する化合物では、酸化防止剤などラジカル停止剤を加えていることがよくあります。この理由は、停止剤がなければ分子同士がラジカル反応を起こし、重合反応によってポリマーになるからです。
位置選択性とラジカルの安定性
なおラジカル反応を利用するとき、考えなければいけないのが位置選択性です。アルキル鎖のどこがラジカルと反応し、どのような生成物を得られるのか理解しなければいけません。
位置選択性については既に説明しています。位置選択性は生成するラジカル中間体の安定性が大きく寄与します。再びラジカルの安定性を記すと、以下のようになります。
- 第三級ラジカル > 第二級ラジカル > 第一級ラジカル
そのためラジカルが生成するとき、置換基の多いラジカルの生成が優先されます。例えば、以下のようになります。
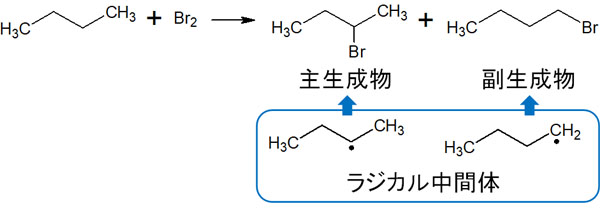
ラジカル中間体を確認すると、今回の場合はより安定な第二級ラジカルが優先して生成されます。そのため、主化合物は一つです。
アリル化合物、ベンジル化合物の安定性
なお、化合物によってはアリル化合物やベンジル化合物も存在します。こうした化合物がラジカルをもつ場合、以下のような構造式になります。
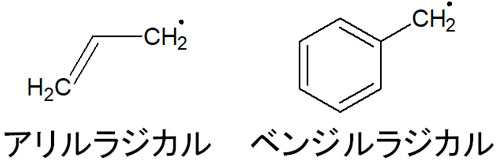
アリルラジカルやベンジルラジカルの中間体は安定性が高いです。もちろんラジカルのため、反応性に優れます。ただ第三級ラジカルよりも、アリルラジカルやベンジルラジカルは安定性が高いことで知られています。ラジカルの安定性は以下のようになります。
- ベンジルラジカル>アリルラジカル>第三級ラジカル>第二級ラジカル>第一級ラジカル
この順番になる理由としては、アリルラジカルやベンジルラジカルは以下のような共鳴構造式を書けるからです。
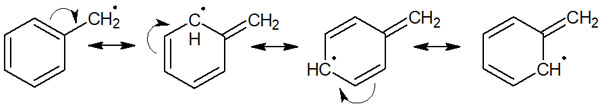
これらを理解したとき、どのような位置選択性によって反応が進むのか理解できるようになります。例えば以下の反応では、2種類の反応を考えることができます。
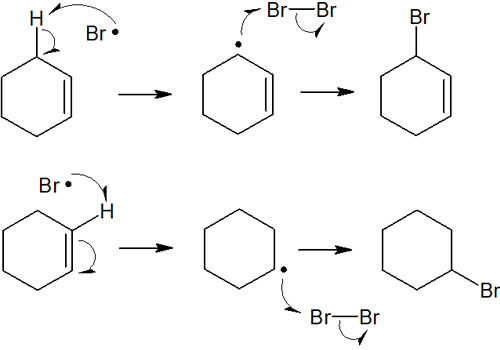
ただ、実際に起こる反応は一つだけです。中間体ではアリルラジカルまたは第二級ラジカルを描くことができます。
ラジカルではベンジルラジカルの安定性が高いです。そのため、生成物は3-ブロモシクロヘキセンです。上図にある化合物のうち、上側の化合物(3-ブロモシクロヘキセン)を選択的に得ることができます。これがラジカル反応での位置選択性です。
反応性の高い不対電子による合成反応
一般的な化学反応ではないため、ラジカル反応に対して苦手意識をもつ人は多いです。不対電子をもつ不安定な中間体がラジカルであり、連鎖反応によって次々と反応を起こす特徴があります。
ただ、ラジカル反応は新たな結合を作るときに有効です。酸と塩基の関係による反応としては、求核置換反応や付加反応、開裂反応などが知られています。ラジカル反応を利用すれば、これらの化学反応では合成できない化合物を得ることができます。
またラジカルではハロゲンや過酸など、ホモリシスを起こす開始剤が存在することで反応がスタートします。また、ラジカル引き抜きや二重結合への付加など起こる反応は決まっています。ラジカル中間体には安定性の順番があり、位置選択性もあります。
これらの性質を理解すれば、ラジカル反応によってどのような化合物を得られるのか理解できるようになります。






