有機化学で非常に重要な要素に光学異性体(鏡像異性体)があります。キラリティーとも呼ばれており、同じ構造式を有しているようにみえたとしても、キラル中心があることで、まったく異なる化合物が混じりあっている状態となります。
有機化学では、光学異性体はまったく違う化合物なので明確に分けなければいけません。これは、キラル中心を有することで化合物の性質が変わるからです。それにも関わらず、光学異性体をそれぞれ分けて合成するのは難しいです。
それでは、どのようにキラル化合物を考えればいいのでしょうか。
立体化学で考えなければいけないのが不斉炭素原子です。キラル化合物の性質や考え方について、ここでは基礎を解説していきます。
もくじ
不斉炭素原子をもつとキラル化合物になる
1つの炭素原子に対して、4つの置換基が結合できます。このとき4つの置換基がすべて異なる場合、光学異性体(鏡像異性体)となります。不斉炭素原子(キラル炭素)を有することで、キラル化合物と呼ばれるようになります。
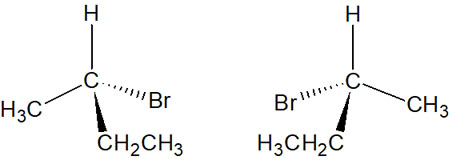
このように、光学異性体の関係にある2つの化合物をエナンチオマーといいます。
キラル中心を説明するとき、右手と左手の関係が例として頻繁に利用されます。右手と左手は鏡に映したように、互いに左右対称です。光学異性体でも同じように、鏡に映したときに左右対称になります。
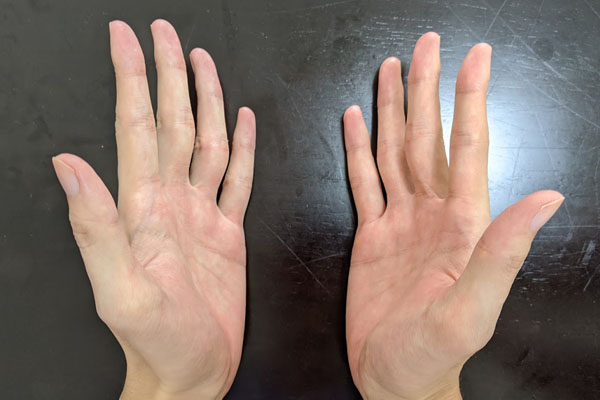
しかし、右手と左手は完全に重ね合わせることができません。以下のように、同じ形を作ろうとしても無理です。
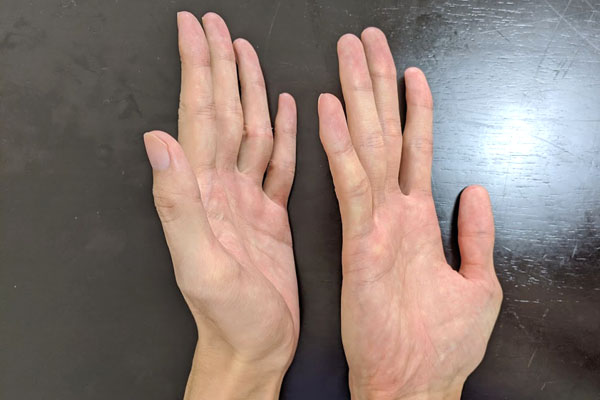
エナンチオマーは同じ構造式を有するものの、完全に違う化合物だと認識しなければいけません。ちなみにキラル中心を有する化合物にはキラリティーがあります。一方でキラル化合物ではない場合、アキラルと呼ばれます。
キラリティーは炭素原子に4つの異なる置換基が結合しているときに考慮します。そのため二重結合や三重結合では、キラリティーはありません。もちろん二重結合ではシス・トランスの異性体を考慮する必要があります。シス・トランスは光学異性体とは異なる異性体であり、同じ異性体ではありません。
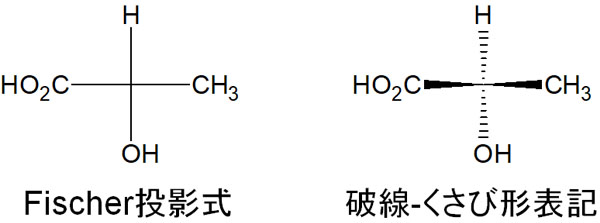
表記はFischer投影式と破線-くさび形表記
それでは、これらキラル化合物はどのように表記すればいいのでしょうか。光学中心を有する化合物の場合、2つの表記方法があります。一つはFischer投影式であり、もう一つが破線-くさび形表記です。
キラル中心があったとしても、分子を平面で記す方法がFischer投影式です。一方の破線-くさび形表記では、置換基がどこにあるのか立体的に記す手法になります。
キラリティーを有する化合物では、どちらの方法も広く利用されています。そのため、どちらを利用してもいいです。
ただ一般的には、破線-くさび形表記が広く利用されています。破線-くさび形表記では、より分子構造を正確に表記できるからです。
一方のエナンチオマー合成は難しくラセミ体となる
有機化学で光学異性体(鏡像異性体)を見極めるのがなぜ重要なのでしょうか。それは、エナンチオマーによって性質が異なるからです。
有名なのはサリドマイドです。過去、サリドマイドは睡眠薬として発売されていました。ただキラリティーがあり、一方は催眠作用があるものの、もう一方は胎児に奇形をもたらす作用があります。その結果、薬害を引き起こしました。
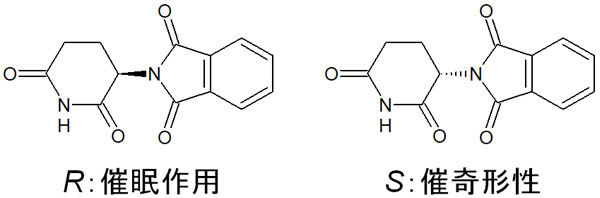
エナンチオマーはそれぞれ、生理活性(生体内での働き)がまったく異なります。それでいて、有機化学では一方のエナンチオマーだけを合成するのが非常に難しいです。一方のエナンチオマー(光学活性のある化合物)を選択的に得られることはほぼなく、ほとんどのケースでラセミ化します。
2つのキラル化合物が均等に混じっている状態をラセミ体といいます。キラル中心があると、化合物のラセミ化を避けるのは難しいのです。
・キラル化合物を分ける方法
それでは、一方のエナンチオマーだけを得たい場合はどのようにすればいいのでしょうか。これについて、キラリティーを有する触媒を利用する方法があります。普通の触媒ではなく、キラル活性を有する触媒により、特定のエナンチオマーだけを得るのです。
特殊な触媒を利用すれば、ラセミ体ではなく一つのエナンチオマーだけ得られることがあります。
または、クロマトグラフィーによって分離してもいいです。キラル活性のある触媒を利用して合成するにしても、実際のところ単一のエナンチオマーを得るのは高度な知識と技術が必要です。そこで、キラルな吸着剤を利用することで、化合物を分離します。
一般的なカラムクロマトグラフィーでは、ラセミ体を分けることはできません。ただキラリティーのある固定相(キラルカラム)を利用し、カラムクロマトグラフィーを実施することで、エナンチオマーの混合物を分離できるようになります。
キラル中心があるものの、光学活性のないメソ体
それでは、キラル中心があれば必ず光学異性体となるのでしょうか。これについて、不斉炭素原子があるからといって、常にキラリティーがあるとは限りません。光学活性のないケースもあります。
特にキラル炭素原子が2つ以上ある場合、光学活性を有さないことがあります。これをメソ体といいます。
どのようなとき、キラル中心があるにも関わらず、光学異性体(鏡像異性体)のない化合物となるのでしょうか。例えば、2,3-ジブロモブタンは以下のように4つの構造式を書くことができます。
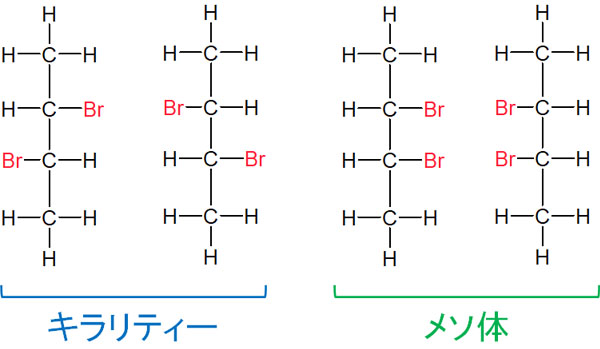
Fischer投影式で記しましたが、左にある2つの化合物はキラリティーがあります。しかし、右にある2つの化合物はキラリティーがありません。メソ体では、180°回転させることでまったく同じ化合物になります。キラル中心があっても、左右対称の場合は光学異性体ではないのです。
2つの物質を重ね合わせることができるため、メソ体はアキラルな性質を有するといえます。光学活性のない化合物がメソ体です。
RS表記で立体配置を理解する
光学活性のある分子の立体を記載するとき、DL表記を利用することがあります。ただ、DL表記は相対的な方法です。そこで有機化学ではDL表記ではなく、絶対的な表記法であるRS表記を利用するのが一般的です。
RS表記の方法としては、以下のルールに従いましょう。
- 原子番号の大きい順にランキングを付ける
- 置換基が同じ場合、原子に結合している置換基で判断する
例えば以下の分子だと、ランキングは以下のようになります。
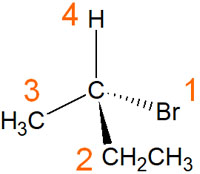
この分子の中で、最も原子番号の大きいのは臭素原子です。また、最も順位が低いのは水素原子です。
2番目に大きい原子番号は炭素原子です。ただ同じ炭素原子が結合しているため、この場合は炭素原子に結合している置換基で判断します。そのため、メチル基(-CH3)とエチル基(-CH2CH3)ではエチル基のほうが優先順位は高いです。
このようにして、RS表記では置換基ごとにランキングを付けます。
時計回りはR体、反時計回りはS体となる
ランキングを付けた後、RなのかSなのかを決める必要があります。RS表記では、以下の手順によって決めていきます。
- 4番目の置換基を奥に置く
- 時計回り(右回り)はR体、反時計回り(左回り)はS体
例えば先ほどの化合物であれば、4番目の置換基は水素原子です。水素原子を奥に置く必要があるため、分子の下側から化合物を見なければいけません。
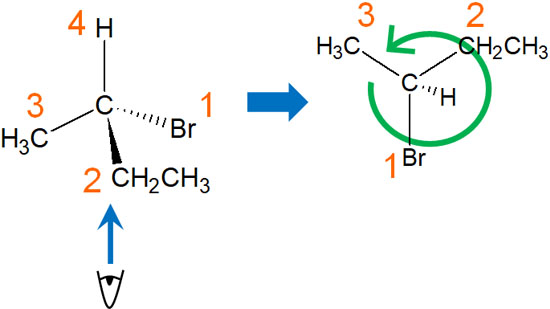
分子の立体を頭の中で想像する必要があります。または、紙に書くといいです。そうすると、置換基のランキングが時計回りなのか反時計回りなのかを判断できるようになります。この分子の場合、反時計回りになっています。そのためS体と判断します。
参考までに、シス・トランスでのEZ異性体でも同様に原子番号の大きさでランキングを付け、EなのかZなのかを判断します。EZ異性体と同じように、キラル化合物のRSも同じ考え方によってランキングを付けます。
2つの不斉炭素原子をもつとジアステレオマーを生じる
ここまで、不斉中心を有する化合物の性質やRS表記について解説してきました。それでは、不斉炭素原子が分子内に2つ以上あるとどうなるのでしょうか。
メソ体については既に説明しました。ただ、左右対称のメソ体となる化合物は非常に少なく、多くの場合はキラリティーを有することになります。このときエナンチオマーだけでなく、ジアステレオマーという概念を理解しなければいけません。
2つのキラル中心があると、以下の4パターンの異性体が存在することになります。
- R, R
- R, S
- S, R
- S, S
これらの化合物のうち、立体異性体ではあるがエナンチオマーではないものをジアステレオマーといいます。例として、以下の化合物でのエナンチオマーとジアステレオマーの関係を記します。
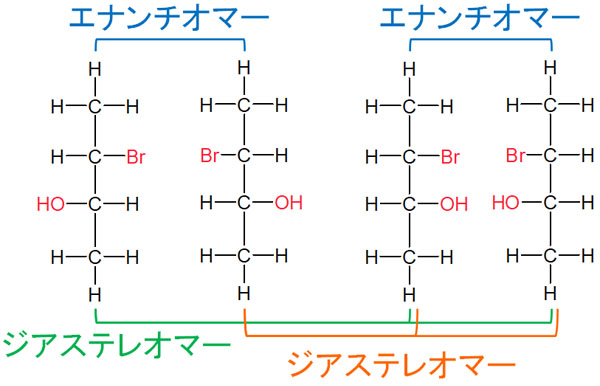
エナンチオマーとジアステレオマーの違いとしては、鏡写しの関係になっているかどうかです。キラリティーがあるものの、エナンチオマー(鏡写しの関係)ではない場合、ジアステレオマーとなります。
エナンチオマーは融点や沸点など、物理的性質は同じです。化学的性質についても、旋光度以外は同じです。
一方でジアステレオマーは物理的性質が異なります。エナンチオマーを分離するのは高度な技術が必要です。一方でジアステレオマーでは、物理的性質が異なるのでエナンチオマーに比べると判別しやすいといえます。
光学活性のある化合物を立体化学で考える
有機化学では、多くのケースで分子を平面で記します。ただ現実世界では、分子は立体で存在しています。そのため立体化学で考えなければいけません。
立体化学で重要な分野の一つに光学異性体があります。キラル中心を有することで、光学活性をもつようになるのです。その結果、エナンチオマーを生じます。旋光度や医薬品の生理活性を除くと、エナンチオマーの性質は同じです。
そのため区別するのが難しいものの、同一化合物ではないため、明確に見極めなければいけません。そこで、RS表記を用いて両者の違いを区別できるようにしましょう。
また2つ以上の不斉炭素原子がある場合、エナンチオマーだけでなくジアステレオマーを生じるようになります。またキラル中心が2つ以上ある場合、メソ体として存在することで、光学活性を有さないケースもあります。
これら光学異性体の性質を理解することで、立体化学の知識が深まるようになります。分子を立体で考える必要があるので難しいですが、これら化合物を区別できるようにしましょう。






