化学反応の中でも、最も単純な反応の一つが酸と塩基が関わる化学反応です。酸性の物質と塩基性(アルカリ性)の物質が反応することによって、どちらの性質も持たない物質へと変化するのです。酸性でも塩基性でもない物質は中性であり、この反応を中和反応といいます。
酸と塩基にはそれぞれ価数があります。価数に応じて、反応する化合物の数が変わります。
このとき、水中でどれだけイオンの状態で存在しているのかによって酸や塩基の強さが変わります。また反応させる物質の酸性や塩基性の強弱によって、生成物質の性質が変化します。酸と塩基では、生成物の性質を含めて理解しなければいけません。
酸と塩基では中和反応での計算問題を解いたり、生成物の性質を答えられるようになったりする必要があります。そこで、酸と塩基の性質を解説していきます。
もくじ
アレニウスの定義とブレンステッド・ローリーの定義
酸と塩基には定義があります。最も単純な酸と塩基の定義がアレニウスの定義です。私たちにとってもっとも馴染みがあり、理解しやすい定義がアレニウスの定義になります。
アレニウスの定義では、酸と塩基を以下のように定義しています。
- 水中でH+を生じる物質が酸であり、水中でOH–を生じる物質が塩基である。
例えば塩化水素(HCl)は水中でH+を生じて酸性になります。また水酸化ナトリウム(NaOH)は水中でOH–を生じて塩基性(アルカリ性)になります。
アレニウスの定義は水中のみを想定しています。ただ実際の化学反応は空気中で起こることがありますし、水が存在しない有機溶媒で酸や塩基が発生することもあります。つまり、アレニウスの定義では不十分です。
そこで、より多くの化学反応で利用できるようにブレンステッドとローリーは以下のように酸と塩基を定義しました。
- ほかの物質にH+を与えることができる物質が酸であり、ほかの物質からH+を受け取る物質が塩基である。
例えば塩化水素(HCl)の場合、水と反応するときにH+を与えます。そのため、酸であるとわかります。
- HCl + H2O → H3O+ + Cl–
またアンモニアが水と反応するとH+を受け取ることによってNH4+となります。そのためアンモニアは塩基です。
- NH3 + H2O → NH4+ + OH–
なお大学化学とは異なり、高校化学では実際のところ「H+が発生する場合は酸であり、OH–が発生する場合は塩基である」という認識で問題ありません。ただ、こうした酸と塩基の定義があることを理解しましょう。
酸と塩基の価数を知る
酸と塩基による化学反応を理解するとき、価数を学ばなければいけません。そこで、酸の価数と塩基の価数を理解しましょう。
いくつのH+を与えることができるのかを表すのが酸の価数です。例えば塩酸(HCl)は一つのH+を与えることができます。この場合は1価の酸です。また、硫酸(H2SO4)は2つのH+を与えることができます。この場合は2価の酸です。
酸の価数で酸を分類分けすると以下のようになります。
- 1価の酸:塩酸 HCl、硝酸 HNO3、酢酸 CH3COOH
- 2価の酸:硫酸 H2SO4、炭酸 H2CO3、シュウ酸 (COOH)2
- 3価の酸:リン酸 H3PO4
塩基についても同様に考えます。OH–を与えることのできる数(H+を受け取れる数)によって塩基の価数が変化します。
- 1価の塩基:水酸化ナトリウム NaOH、水酸化カリウム KOH、アンモニア NH3
- 2価の塩基:水酸化カルシウム Ca(OH)2、水酸化銅(Ⅱ) Cu(OH)2
- 3価の塩基:水酸化アルミニウム Al(OH)3、水酸化鉄(Ⅲ) Fe(OH)3
このようにH+やOH–に着目することで価数を区別しましょう。
電離度:水に溶けるときに電離している割合
なお酸と塩基で理解しなければいけないこととして電離度があります。物質が水に溶け、陽イオンと陰イオンに分かれる現象を電離といいます。電離度とは、どれだけ電離しているのかを表す指標です。
電離度αの計算は簡単です。水に溶かした物質の物質量(mol)のうち、電離している物質の物質量(mol)の割合を計算すれば電離度αを計算できます。
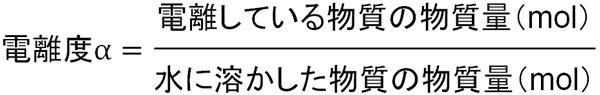
例えば1molの物質を溶かし、そのうち0.2molが電離してイオンになっている場合、電離度αは0.2です。
・価数と電離度を利用し、H+の物質量を計算する
また酸の価数と電離度がわかれば、水中に存在するH+の物質量がわかります。例えば1molの物質を溶かし、電離度が0.2なのであれば、水中にイオンとして0.2molが存在していることになります。このとき、化合物の酸の価数によって以下のようにH+の物質量が変化します。
- 1価の酸:\(1×0.2=0.2\)
- 2価の酸:\(2×0.2=0.4\)
- 3価の酸:\(3×0.2=0.6\)
酸の価数が多くなれば、当然ながらそれに応じて水溶液中のH+の物質量は多くなります。
なお、同じことは塩基にもいえます。塩基性物質を水に溶かすとき、電離度がわかれば、水中でどれだけイオンの状態で存在しているのかわかります。また塩基の価数と電離度を利用することによって、水中に存在するOH–の物質量がわかります。
強酸や強塩基は電離度の大小で決まる
なぜ電離度を学ぶ必要があるかというと、電離度が酸や塩基の強さに直結するからです。酸には強酸と弱酸があります。また塩基には強塩基と弱塩基があります。つまり、酸性や塩基性には強さがあるのです。それでは、どのように酸や塩基の強弱が決定されるのでしょうか。
水に溶かすとき、ほぼイオンとして存在する酸は強酸であり、ほぼイオンで存在する塩基は強塩基です。つまり、電離度αが1に近い値の場合は強酸や強塩基となります。強酸や強塩基には以下の種類があります。
- 強酸:塩酸 HCl、硝酸 HNO3、硫酸 H2SO4
- 強塩基:水酸化ナトリウム NaOH、水酸化カリウム KOH、水酸化カルシウム Ca(OH)2
一方、水に溶けるとき一部がイオン化する物質も存在します。電離度αが0.1や0.2などのように、水中で少しイオン化する物質が弱酸や弱塩基です。
弱酸は一部のみイオン化して水中でH+を作り、弱塩基は一部のみイオン化してOH–となります。H+やOH–の量が少ない場合、酸性や塩基性は弱くなります。そのため、これらの物質は弱酸や弱塩基と呼ばれます。
弱酸や弱塩基には以下の種類があります。
- 弱酸:酢酸 CH3COOH、炭酸 H2CO3、シュウ酸 (COOH)2、リン酸 H3PO4
- 弱塩基:アンモニア NH3、水酸化銅(Ⅱ) Cu(OH)2、水酸化アルミニウム Al(OH)3、水酸化鉄(Ⅲ) Fe(OH)3
酸と塩基の強弱の見分け方については、覚えるしか方法がありません。ここまで解説した強酸や弱酸、強塩基、弱塩基は代表的な物質であるため、すべての覚えるようにしましょう。覚え方としては、代表的な強酸と強塩基を覚えれば十分です。強酸や強塩基を覚えれば、それら以外は弱酸や弱塩基です。
価数は酸や塩基の強さと関係ありません。酸や塩基の強さというのは、あくまでも物質の性質によって決まります。
中和反応と塩の種類を学ぶ
酸と塩基の種類を学んだら、ようやく中和反応を理解できます。H+とOH–が化学反応を起こすとき、水(H2O)が生成されます。同時に、中和反応が起こることで、陽イオンと陰イオンによって結合した化合物が生成されます。酸・塩基反応によって生成したイオン化合物を塩(えん)といいます。
例えば塩酸と水酸化ナトリウムの反応を確認すると、中和反応は以下のようになります。
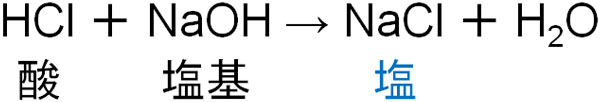
また炭酸と水酸化ナトリウムが反応する場合は以下のようになります。
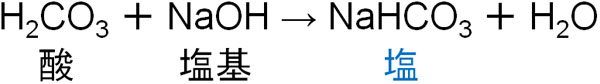
中和反応では、必ず塩が生成することを理解しましょう。重要なのは、塩には酸性塩、塩基性塩、正塩の3種類に分かれることです。
化学式の中にHがある場合、酸性塩といいます。一方で化学式の中にOHがある場合、塩基性塩です。また化学式にHもOHもない場合、正塩です。具体的な塩には、以下のような種類があります。
- 酸性塩:硫酸水素ナトリウム NaHSO4、炭酸水素ナトリウム NaHCO3
- 塩基性塩:塩化水酸化銅 CuCl(OH)
- 正塩:塩化ナトリウム NaCl、酢酸ナトリウム CH3COONa、炭酸カルシウム CaCO3
参考までに、化学で重要になるのは酸性塩と正塩です。塩基性塩が利用されるケースは稀ですし、試験でも問われる機会が少ないです。一方、酸性塩と正塩は必ず理解しましょう。
塩を溶かすとき、水溶液が酸性や塩基性になることがある
先ほど、塩の分類を行いました。次は、塩を水に溶かすときの分類をしましょう。
塩化ナトリウム(NaCl)を溶かすとき、水溶液は中性であると多くの人が既に理解しています。ただ塩の中には、中性ではなく溶液を酸性にしたり、塩基性にしたりすることがあります。この現象の違いをどのように判断すればいいかというと、反応させる前の物質に着目しましょう。
・正塩を溶かす場合の水溶液の性質
まず正塩の場合、以下のように判断します。

例えば塩酸(HCl)と水酸化ナトリウム(NaOH)を反応させるとき、生成する塩は塩化ナトリウム(NaCl)です。塩化ナトリウムが中性なのは、強酸であるHClと強塩基であるNaOHを反応させてできる物質だからです。
一方、強酸と弱塩基を反応させて生成する塩を水に溶かす場合、水溶液は酸性になります。例えば塩酸(HCl)とアンモニア(NH3)を反応させると塩化アンモニウム(NH4Cl)ができます。塩酸は強酸であり、アンモニアは弱酸です。そのため、塩化アンモニウムを水に溶かすと酸性になります。
塩化アンモニウム(NH4Cl)を溶かす場合、以下のように陽イオンと陰イオンに分かれます。
- NH4Cl → NH4+ + Cl–
塩化物イオン(Cl–)は塩酸由来であるため、電離度が非常に高く、水溶液中ではほぼすべてがCl–で存在しています。
一方、アンモニウムイオンは弱塩基であるアンモニア由来です。そのため、水溶液中では一部が陽イオンとして存在します。その結果、以下のように水分子と反応することによってオキソニウムイオンを生じます。
- NH4+ + H2O ⇆ NH3 + H3O+
オキソニウムイオン(H3O+)とは、要は水素イオン(H+)のことです。電離度が低く、一部がイオンになる性質があるため、強酸と弱塩基によって生成した塩が水に溶けると酸性を示すようになるのです。
反対の現象は弱酸と強塩基によって生成した塩にも起こります。この場合、塩を溶かすと塩基性を示すようになります。例えば酢酸(CH3COOH)と水酸化ナトリウム(NaOH)を反応させると、酢酸ナトリウム CH3COONaを得ることができます。
Naは強塩基である水酸化ナトリウム由来であるため、水中でほぼすべてが陽イオンとして存在しています。
- CH3COONa → Na+ + CH3COO–
ただ酢酸は弱酸由来であり、電離度が低く、一部が陰イオンとして水中に存在することになります。そのため、水分子と反応して水酸化物イオンを生成します。
- CH3COO– + H2O ⇆ CH3COOH + OH–
こうして、酢酸ナトリウムを水に溶かすと塩基性を示すようになります。
・酸性塩は硫酸水素ナトリウムと炭酸水素ナトリウムが重要
なお酸性塩についても、基本的にはここまでの説明と同様の方法によって、「塩を溶かすときに酸性になるのか、それとも塩基性になるのか」を説明することができます。代表的な酸性塩には以下があります。
- 酸性を示す酸性塩:硫酸水素ナトリウム NaHSO4
- 塩基性を示す酸性塩:炭酸水素ナトリウム NaHCO3
正塩のように、「強酸と強塩基に由来する塩なので中性になる」という判断はできません。ただ、なぜ上記の性質を示すのかはここまで説明した方法によって判断可能です。
硫酸(強酸)や水酸化ナトリウム(強塩基)は電離度が高く、水中でほぼすべてがイオンとして存在します。そのため、硫酸水素ナトリウムが溶けると以下のイオンに分かれます。
- NaHSO4 → Na++ H+ + SO42-
こうして、水中にH+が存在することになるので酸性を示します。
一方の炭酸水素ナトリウムでは、ナトリウムイオンは水酸化ナトリウム(強塩基)に由来します。そのため、水中でほぼすべてナトリウムイオンとして存在しています。
- NaHCO3 → Na+ + HCO3–
しかし炭酸は弱酸由来であり、電離度は弱く、水中では一部が炭酸イオンとして存在することになります。そのため炭酸イオンは水と反応し、水酸化物イオンを生成します。
- HCO3– + H2O ⇆ H2CO3 + OH–
正塩と酸性塩では、塩を溶かすときの液性を見極める方法が異なります。ただ水溶液が酸性を示すのか、それとも塩基性を示すのか判断するときの考え方は同じです。
弱酸の遊離と弱塩基の遊離
ここまでの解説によって、強酸を使うのか、それとも弱酸を使うのかによって塩の性質が違うとわかります。また強塩基を使うのか、それとも弱塩基を利用するのかによっても塩の性質が変化します。
強酸や強塩基を使う場合、電離度が高いため、積極的にイオンになろうとします。この性質は弱酸の遊離や弱塩基の遊離で利用されることがあります。
・弱酸由来の塩に強酸を加える
例えば、弱酸由来の塩に酢酸ナトリウム(CH3COONa)があります。弱酸である酢酸と強塩基である水酸化ナトリウムを利用することにより、酢酸ナトリウムを得ることができます。
ここで、酢酸ナトリウムに塩酸(HCl)を加えましょう。この場合、以下のように強酸と強塩基に由来する塩(塩化ナトリウム:NaCl)が生成します。
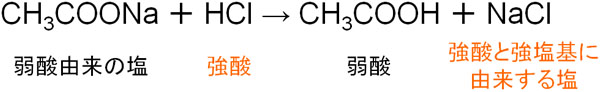
強酸は電離度が高く、H+を放出してイオンになりたいと考えています。そこで弱酸由来の塩にH+を押し付け、強酸は強塩基由来の物質(今回はナトリウム)とイオン結合を作ります。電離度が高い物質同士でイオン結合を作るため、イオンとして存在しやすくなります。
・弱塩基由来の塩に強塩基を加える
同じ現象は弱塩基由来の塩についても起こります。例えば、弱塩基由来の塩に塩化アンモニウム(NH4Cl)があります。塩化アンモニウムに対して、強塩基として水酸化ナトリウム(NaOH)を加えると、新たな塩として塩化ナトリウム(NaCl)を生成します。
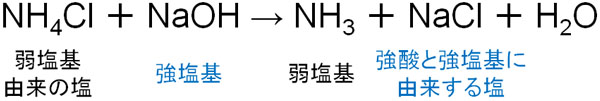
強塩基は電離度が高いため、OH–を放出してイオンになりたいと考えています。そのため塩化アンモニウムと水酸化ナトリウムを反応させると、ナトリウムは強塩基由来の塩化物イオン(Cl–)とイオン結合を形成するのです。
中和反応での計算問題を解く
それでは、中和反応に関する計算問題を解きましょう。中和反応が完了するためには、必ず以下の状態を満たす必要があります。
- H+の数=OH–の数
酸・塩基反応というのは、酸性物質と塩基性物質の反応になります。当然、中和反応が完了するためにはH+の数とOH–の数が同じでなければいけません。強酸や弱酸、強塩基、弱塩基に関係なく、必ずH+の数とOH–の数を同じにしましょう。
例えば1mol/Lの酸性水溶液について、1Lに含まれるH+の物質量は以下のようになります。

弱酸で電離度が低くても、H+を放出するため、塩基があれば中和反応が素早く起こります。そのため中和反応の計算では、強酸や弱酸に関係なくH+の物質量を計算しましょう。同じことは強塩基と弱塩基にもいえます。
それでは、以下の問題の答えは何でしょうか。
- 0.4mol/Lの硫酸水溶液(H2SO4)200mLについて、1.6mol/Lの水酸化ナトリウム水溶液(NaOH)を利用して中和反応を完了させるとき、必要な水酸化ナトリウム水溶液の量はいくらでしょうか。
まず、0.4mol/Lの硫酸水溶液(H2SO4)200mLに含まれるH+の物質量を計算しましょう。硫酸は2価の酸であるため、200mL(0.2L)の水溶液には0.16molのH+が含まれるとわかります。
\(0.4×0.2×2=0.16\)
そこで、0.16molのH+を中和するために必要な水酸化ナトリウム水溶液の量を計算しましょう。水酸化ナトリウム水溶液の量を\(x\)Lとすると、以下のように計算できます。
\(0.16=1.6x\)
\(x=0.1\)
こうして、必要な水酸化ナトリウム水溶液の量は0.1L(100mL)であるとわかります。
酸と塩基による反応は化学で重要
酸には種類があり、塩基にも種類があります。最も重要な分類が強酸や弱酸、強塩基、弱塩基です。そこで、酸と塩基の強弱の関係を覚えましょう。どの酸が強酸であり、どの酸が弱酸なのか覚えていない場合、問題を解くことができません。これは塩基についても同様です。
強酸や強塩基の場合、電離度が強いです。一方で弱酸と弱塩基では電離度が弱いです。この性質の違いにより、正塩や酸性塩を水に溶かすとき、塩によって液性がそれぞれ異なります。塩によっては、水に溶かすことで酸性や塩基性を示すことがあるのです。
また強酸や強塩基を利用すると、弱酸の遊離や弱塩基の遊離が可能になります。塩というのは、強酸と強塩基に由来する塩を作る性質があるのです。
さらには、中和反応に必要な物質の量(または水溶液の量)を計算できるようになりましょう。H+とOH–の物質量を同じにすれば中和反応の計算を行えるようになります。酸・塩基は化学の基本であるため、これらの内容を理解しましょう。






