無機化学では15族元素を学びます。15族元素には窒素NやリンP、ヒ素Asなどがあります。この中で最も重要な元素は窒素です。無機化学ではリンも学びますが、窒素分子や窒素を含む化合物が重要なのです。
窒素を含む化合物にはアンモニアや一酸化窒素、二酸化窒素、硝酸などがあります。これらはすべて無機化学で理解しなければいけない化合物です。
一方、窒素に比べるとリンの重要度は落ちます。リンで理解しなければいけないのは同素体の種類や十酸化四リン、リン酸です。
それでは、窒素とリンの性質はどのようになっているのでしょうか。ここでは、15族元素の中でも窒素とリンについて解説していきます。
もくじ
第15元素で最も重要な窒素
元素周期表で同じ族の場合、似た性質をもつようになります。15族元素は元素周期表の中で以下が該当します。
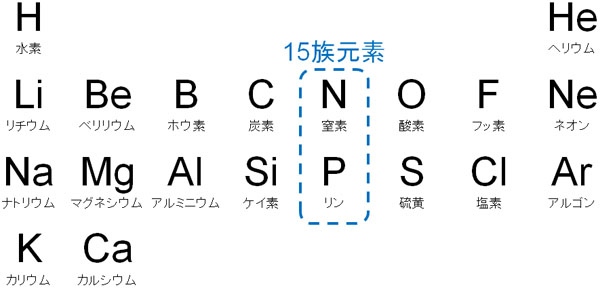
そこで、まずは窒素分子N2の性質から確認しましょう。窒素は空気の大部分を占めます。以下が空気の構成成分の割合です。
- 窒素(N2):約78%
- 酸素(O2):約21%
- アルゴン(Ar):0.93%
酸素O2とは異なり、窒素N2は他の分子と反応しません。無色・無臭であり、三重結合によって安定して存在しているのが窒素分子です。化学反応を起こすためには、結合が切れる必要があります。ただ窒素は三重結合によって強く共有結合しているため、結合が切断されにくいのです。
そのため窒素は不活性ガスとして知られています。容器内に窒素を充填させれば、気体による化学反応は起こりません。また空気の主成分でもあるため人体に無害であり、窒素ガスはひんぱんに利用されるのです。
なお窒素の実験的製法では、亜硝酸アンモニウム(NH4NO2)を加熱することによって分解し、水上置換を利用してN2を集めます。
- NH4NO2 → N2 + 2H2O
ちなみに工業的製法としては、液体空気(窒素や酸素などの混合物)を分留することで窒素を得ることができます。
アンモニア(NH3):アンモニアの性質とハーバー・ボッシュ法
窒素を含む化合物として、アンモニア(NH3)は最も一般的な分子の一つです。アンモニアは強烈な刺激臭のある気体です。トイレで強烈な刺激臭がするのは、主にアンモニアが原因です。
アンモニアは水に対して非常に溶けやすく、弱塩基性を示す性質があります。水溶液中では、以下のように水と反応することで一部が水酸化物イオンになるのです。
- NH3 + H2O ⇆ NH4+ + OH–
またアンモニアは空気中で塩化水素(HCl)と触れると白煙を生じます。アンモニアは塩基性であり、塩化水素は酸なので、空気中で中和反応が起こることで塩化アンモニウム(NH4Cl)を生じます。
- NH3 + HCl → NH4Cl
塩化アンモニウムが白煙の正体です。
・アンモニアの実験的製法
アンモニアの性質は難しくないため、問題なく理解できると思います。次に、アンモニアの製法を学びましょう。実験室では、塩化アンモニウムNH4Clと水酸化カルシウムCa(OH)2を混ぜ、熱を加えることでアンモニアを発生させることができます。
- 2NH4Cl + Ca(OH)2 → CaCl2 + 2H2O + 2NH3
実際に実験室でアンモニアを発生させる場合、以下のような装置を利用します。
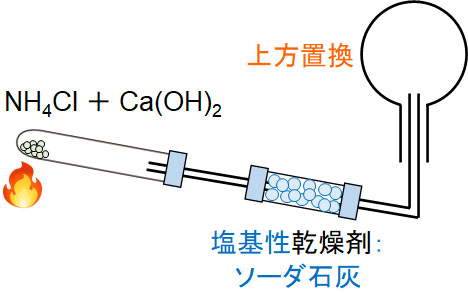
アンモニアの実験的製法での注意点は3つです。
1. 試験管の底部を少し高くする
化学反応式をみてわかる通り、塩化アンモニウムNH4Clと水酸化カルシウムCa(OH)2を反応させるとH2Oが発生します。発生した冷たい水が試験管の過熱部分に当たると、試験管が割れてしまうリスクがあります。そこで試験管の底に水がたまらないよう、試験管の底部を少し高くします。
2. 塩基性乾燥剤(ソーダ石灰)を利用する
前述の通り水が発生するため、アンモニアを得るためには乾燥させなければいけません。そこで水を乾燥させるため、塩基性乾燥剤(ソーダ石灰)を利用しましょう。
アンモニアは塩基性物質であるため、乾燥剤は塩基性乾燥剤である必要があります。酸性乾燥剤を利用する場合、塩基性であるアンモニアは酸性乾燥剤と中和反応を起こすため、アンモニアを得ることができません。
3. 上方置換を利用してアンモニアを得る
アンモニアは空気よりも軽いです。また、水に溶けやすい性質があります。そこで、上方置換を利用してアンモニアを得ましょう。
・アンモニアの工業的製法:ハーバー・ボッシュ法(ハーバー法)
なおアンモニアの製法では、工業的製法(大量生産する方法)も理解しなければいけません。アンモニアの工業的製法ではハーバー・ボッシュ法(またはハーバー法)が利用されます。
ハーバー・ボッシュ法では、触媒として四酸化三鉄(Fe3O4)を利用し、窒素と水素を用いてアンモニアを合成します。
- N2 + 3H2 → 2NH3
触媒を利用し、高圧環境にてN2とH2を反応させるとアンモニアを得ることができるのです。
一酸化窒素(NO):水に溶けにくい無色の気体
窒素を含む重要な化合物は複数存在し、その一つが一酸化窒素(NO)です。無色・無臭の気体であり、水に溶けにくい性質があります。
一酸化窒素が空気中に存在すると、酸素と反応することですぐに二酸化窒素(NO2)へと変化します。
- 2NO + O2 → 2NO2
一酸化窒素の発生方法としては、銅(Cu)に希硝酸(HNO3)を加えましょう。以下の反応になります。
- 3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
銅は水素よりもイオン化傾向が低く、イオンになりたくないと考えています。そのため、銅に酸を加えても水素は発生しません。ただ硝酸など、酸化力のある酸を加えると銅は溶けます。このとき水素は発生しないものの、酸化還元反応が起こることで一酸化窒素(NO)が発生するのです。
参考までに、一酸化窒素は私たちの体にとって重要な化合物であり、血管拡張に関与しています。
「気体が私たちの体に作用するのか?」と思うかもしれませんが、気体ではあるものの一酸化窒素は体内で血液の動きに関与しています。また狭心症の治療薬として、一酸化窒素をターゲットにしている薬も存在します。私たちの体内では気体も重要な働きをしているのです。
二酸化窒素(NO2):赤褐色の有毒な気体
先ほど解説した通り、一酸化窒素が空気中の酸素と反応すると二酸化窒素(NO2)が生成されます。一酸化窒素とは異なり、二酸化窒素は赤褐色をした有毒な気体であり、特有の刺激臭があります。
また水に溶けやすい性質があり、H2Oに溶けることで硝酸(HNO3)となります。硝酸は強酸であるため、強い酸性を示します。
- 3NO2 + H2O → 2HNO3 + NO
二酸化窒素(NO2)の製法は一酸化窒素(NO)と似ています。銅に濃硝酸を加えることによって二酸化窒素が生まれます。
- Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
一酸化窒素の生成では希硝酸を利用します。一方、濃硝酸を利用すると二酸化窒素が生成されます。
なお、一酸化窒素(NO)と二酸化窒素(NO2)の混合物を窒素酸化物(NOx)といいます。化石燃料の排ガスに窒素酸化物が多く含まれ、一酸化窒素は空気中で有毒な二酸化窒素になります。また雨が降ると、空気中に存在する二酸化窒素が水に溶けて硝酸を含む酸性の雨となります。これが酸性雨です。
硝酸(HNO3)の性質と製法(オストワルト法)
無色・揮発性のある強酸性の液体が硝酸です。他の強酸水溶液と異なる性質として、硝酸には強い酸化作用があります。
金属にはイオン化傾向があります。水素よりもイオン化傾向が高い金属を強酸水溶液に入れると、水素が発生します。
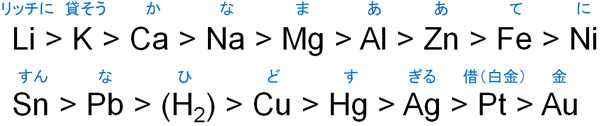
しかし、銅(Cu)や水銀(Hg)、銀(Ag)はイオン化傾向が水素よりも低く、塩酸や希硫酸などの強酸水溶液に入れても反応しません。それに対して、硝酸は前述の通り強い酸化力があるため、銅や銀であっても溶かします。
硝酸を利用して金属を溶かすとき、水素は発生しません。先ほど説明した通り、希硝酸では一酸化窒素(NO)が発生し、濃硝酸では二酸化窒素(NO2)が発生します。そのため濃硫酸と希硫酸を使い分けるのと同じように、硝酸を使うときは濃硝酸と希硝酸を使い分けます。
なお硝酸に金属を入れるとき、アルミニウム(Al)、鉄(Fe)、ニッケル(Ni)については、水素よりもイオン化傾向が大きいにも関わらず硝酸に溶けません。この理由は、硝酸にこれらの金属を入れると金属表面に酸化被膜が形成され、金属が保護されて溶けなくなるからです。この状態を不動態といいます。
また濃硝酸と濃硫酸を3:1の割合で混ぜた液体を王水といいます。プラチナ(Pt)や金(Au)は濃硝酸であっても溶けません。しかし唯一、王水に対してはプラチナや金であっても溶けます。
・硝酸の工業的製法:オストワルト法
硝酸の製法で重要なのは工業的製法であるオストワルト法です。オストワルト法では、アンモニアを出発物質として一酸化窒素を合成し、次に二酸化窒素を作り、最終的に硝酸を得ます。つまり、以下の3ステップを経て硝酸を得ます。
- 4NH3 + 5O2 → 4NO + 6H2O
- 2NO + O2 → 2NO2
- 3NO2 + H2O → 2HNO3 + NO
それでは、これらの式を組み合わせる(すべて足す)ことによって一つの式にまとめると、どのようになるのでしょうか。
やり方として、一酸化窒素(NO)と二酸化窒素(NO2)の両方を式から消すことを考えましょう。まず、二酸化窒素(NO2)を以下のように消しましょう。
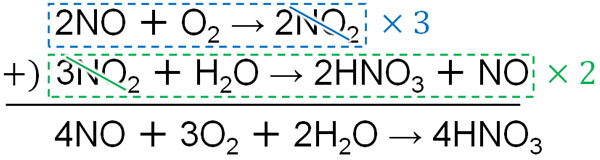
その後、一酸化窒素(NO)を消します。
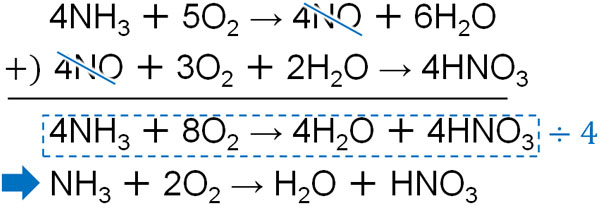
こうして、ハーバー・ボッシュ法によって硝酸を得る化学反応式を作ることができます。またすべての反応を合成した化学反応式を確認すると、アンモニアの酸化によって硝酸を得ています。そのため、ハーバー・ボッシュ法はアンモニア酸化法とも呼ばれています。
単体のリンでは同素体と十酸化四リン、リン酸を理解する
15族元素では窒素が最も重要であり、リンPの重要度は窒素に比べて劣ります。ただヒ素Asなど、ほかの15族元素に比べるとリンが利用される場面は多いです。
リンには同素体があり、黄リンと赤リンがあります。黄リン(P4)は淡黄色のろう状の固体であり、猛毒です。また自然発火するため、空気中ではなく水中で保存しなければいけません。
一方、赤リン(Px)は赤褐色の粉末であり、マッチ棒の先端に利用されています。赤リンは無毒の物質であり、常温では自然発火しません。
| 黄リン(P4) | 赤リン(Px) | |
| 色 | 淡黄色 | 赤褐色 |
| 毒性 | 猛毒 | なし |
| 保存方法 | 水中 | 常温 |
なおリンを含む化合物として、無機化学では十酸化四リンを学びます。リンを空気中で燃焼させることによって、十酸化四リンが生成されます。つまり黄リンや赤リンを燃やすと十酸化四リンを得られます。
- 4P + 5O2 → P4O10
十酸化四リンは吸湿性、脱水性の強い化合物です。そのため、酸性乾燥剤として利用されます。
・弱酸性を示すリン酸(H3PO4)
また十酸化四リンを水に溶かし、加熱するとリン酸(H3PO4)を得られます。リンを含む酸性物質としてリン酸は有名です。
- P4O10 + 6H2O → 4H3PO4
リン酸は3つのH+をもちます。ただリン酸は強酸ではなく、弱酸です。強酸かどうかというのは、水素の保有数と関係ないことに注意しましょう。
15族元素(窒素とリン)の性質を覚える
窒素は空気の主成分であり、非常に重要な元素です。無機化学で15族元素を学ぶとき、リンPの性質を習うものの、最も重要な15族元素は窒素です。
また窒素を含む化合物にアンモニアや一酸化窒素、二酸化窒素、硝酸があります。これらの化合物はどれも重要であるため、それぞれの特徴や製法を理解しましょう。窒素を含む化合物では酸化還元反応が関わることが多いため、イオン化傾向や酸化剤の性質についても復習しましょう。
なおリンには同素体があります。またリンを燃やすと十酸化四リンとなり、十酸化四リンを水に溶かすとリン酸になります。
窒素とリンの性質を理解すれば、無機化学での15族元素を学んだことになります。窒素とリンはひんぱんに利用されるため、これらの元素の性質を把握しましょう。






