有機化学で非常に重要となるのがベンゼン環です。ベンゼン環を有する化合物を芳香族化合物といいます。
ベンゼン環には非常に多くの電子が存在します。いわゆる電子リッチの状態であり、ベンゼン環に存在する電子が他の分子と反応し、有機化学反応を起こすことがあります。これを芳香族求電子置換反応といいます。
ただベンゼン環にて求電子置換反応が起こるとき、どの位置で化学反応が起こるのかは決まっています。これを配向性といいます。より詳しくいうと、芳香族化合物の置換基によって配向性が変わります。
それだけでなく、反応性(どれだけ効率的に反応するのか)も官能基で異なります。ここでは、芳香族求電子置換反応での配向性や反応性が置換基によってどのように違うのかについて解説していきます。
もくじ
芳香族求電子置換反応は場所が異なる
ベンゼン環に対して求電子置換反応が起こるとき、どのような種類の芳香族化合物なのかによって置換する場所が異なります。
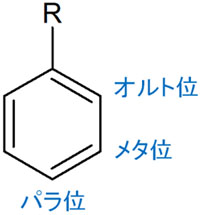
ベンゼン環では、置換基を起点として以下の3つに分けることができます。
- オルト位
- メタ位
- パラ位
例えば、芳香族求電子置換反応としてフリーデルクラフツ反応があります。メトキシベンゼン(アニソール)に対してフリーデルクラフツを行うと以下のような化合物が生成されます。
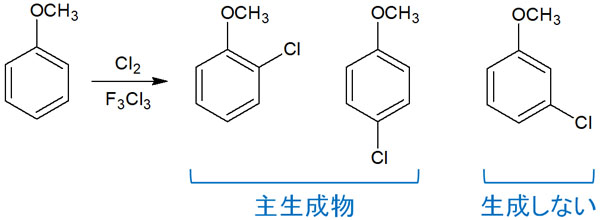
芳香族求電子置換反応により、オルト位またはパラ位に新たな置換基が作られます。なぜ、このように特定の位置に対して選択的に反応するのでしょうか。なぜ、メタ位には置換反応が起こらないのでしょうか。これは、配向性が関与しているからになります。
置換基による共鳴効果(R効果)
芳香族化合物が求電子置換反応を起こすときには、種類があります。ベンゼン環の配向性では以下の2種類を考えましょう。
- オルト・パラ配向性
- メタ配向性
つまりベンゼン環では「オルト・パラで置換反応が起こる」「メタで置換反応が起こる」のどちらかだと理解しましょう。
・配向性の説明方法は人によって異なる
このような配向性を示す理由としては、人によって説明方法がバラバラです。その種類を挙げると、例えば以下のようになります。
- 反応中間体の共鳴構造をたくさん書ける
- 反応中間体でオクテット則を満たす共鳴構造を書ける
- 反応中間体にて、電荷同士の反発がある(または安定がある)
- 共鳴効果(R効果)がある
これらは、どれも正解です。科学の世界では、実験による結果が出てきて、つじつまを合わせるために後で理論を用意するのが一般的です。要は、理解さえできれば説明方法は何でもいいといえます。
ただ芳香族化合物の配向性について理解する場合、共鳴効果(R効果)を用いた説明をするのが最も分かりやすいといえます。分子の共鳴による影響を共鳴効果(R効果)といいます。例えば、アニリンは以下のように共鳴します。
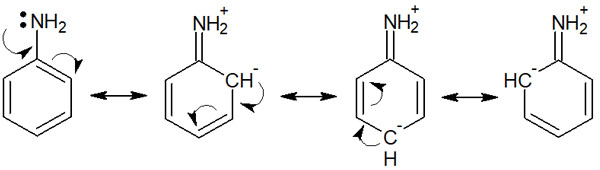
ベンゼン環に存在する置換基が影響することで、このように共鳴します。こうした共鳴の様子を理解すれば、簡単にベンゼン環の配向性を会得できるようになります。
ベンゼン環の配向性は電子供与性・電子吸引性で異なる
それでは、共鳴効果がどのようにして配向性に関わってくるのでしょうか。これについては、芳香環化合物の置換基が電子供与基なのか電子吸引基なのかによって配向性が変わってきます。
共鳴効果では、ベンゼン環の配向性は以下のようになると考えましょう。
- 電子供与基:オルト・パラ配向性
- 電子吸引基:メタ配向性
ベンゼン環に結合している置換基は、電子供与性と電子吸引性の2つに分けることができます。また電子供与基か電子吸引基なのかによって、ベンゼン環の配向性が変わるのです。
なぜ、このようになるのでしょうか。これは、共鳴することでベンゼン環上の電子密度が場所によって異なるからです。
フェノールやアニリンは電子供与基:オルト・パラ配向性
ベンゼン環に結合することで電子供与性を示す官能基としては、代表的なものとして以下が知られています。
- メトキシ基(-OCH3)
- ヒドロキシ基(-OH)
- アミノ基(-NH2)
フェノールやアニリンにある酸素原子・窒素原子は電子供与基として働きます。共鳴構造を書くと、これらの芳香環化合物はオルト位とパラ位で電子密度が高くなります。
以下に、アニリンの共鳴構造を再び記します。
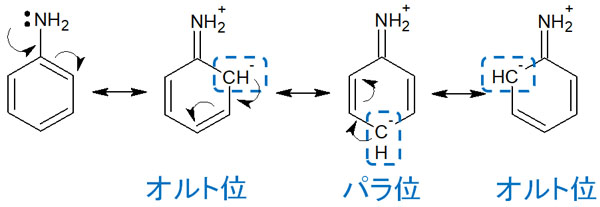
このようにオルト位とパラ位に電子が存在する共鳴を書くことできます。メタではなく、オルトとパラに多くの電子が存在するのです。
有機合成反応では、電子が他の分子に攻撃することで反応を起こします。こうした共鳴構造を見ると、「芳香環求電子置換反応が起こるとき、オルトまたはパラに存在する電子と他の分子が化学反応を起こす」と予測できます。その結果、求電子置換反応がオルトとパラで起こります。
先ほど、メトキシベンゼン(アニソール)ではオルトとパラで置換反応が起こると説明しました。これは電子供与基がベンゼン環に結合することで、オルト・パラ配向性を示すようになるからです。
オルトとパラの配向性は立体障害が関与する
なおオルト・パラ配向性の中で、オルトとパラではどちらが多く生成されるのでしょうか。これは、置換基による影響を大きく受けます。
共鳴構造を見れば分かる通り、オルトは2つの共鳴を書くことができます。一方でパラの共鳴構造は1つです。そのため統計学的には、合成反応によって「オルトの位置に置換基のある化合物」が2倍生まれるはずです。
しかし、実際にはそのようになりません。多くの場合、オルトではなくパラの位置で置換反応が起こります。オルト位に置換基を有する化合物が生まれるものの、パラ位に置換基をもつ化合物が合成される確率が高いのです。
この理由は何でしょうか。それは立体障害です。既に置換基がある状態から、すぐ隣の位置で置換反応を起こすのがオルトです。一方でパラの位置では、置換基との距離が離れているので立体障害は起こりません。
あなたがソファに座るとき、真ん中にデブの人が座っている席を好んで座るでしょうか。その場合、座り心地は非常に悪いです。周囲にいくつもソファがあったとしても、すべてのソファにデブが座っていたらあなたは意識的にそのソファを避けます。

それに対して、離れた場所に誰も座っていないソファを発見すればどうでしょうか。たとえ遠くであっても、あなたは歩いてそのソファに向かい、座ります。
立体障害を嫌うのは、人間も置換基も同じです。置換基が物理的に空間に入れない場合、立体障害が起こります。その結果、オルトではなくパラにて置換反応が起こります。また置換基が大きいほど、立体障害が起こりやすくなります。
ニトロ基、カルボニル基など電子吸引基はメタ配向性
一方で電子吸引基はどうなのでしょうか。電子吸引性を示す置換基には、例えば以下があります。
- カルボニル基(-CO)
- カルボキシ基(-COOH)
- スルホン基(-SO3H)
- ニトロ基(-NO2)
- シアノ基(-CN)
どれも二重結合または三重結合を有する官能基です。これらπ結合を有する置換基では、電子吸引性を有するようになります。
電子吸引基では、メタ配向性になります。芳香環化合物にて求電子置換反応を起こすとき、オルトやパラではなく、メタの位置にて置換反応が起こると考えましょう。例えば、ニトロベンゼンは以下のように共鳴します。
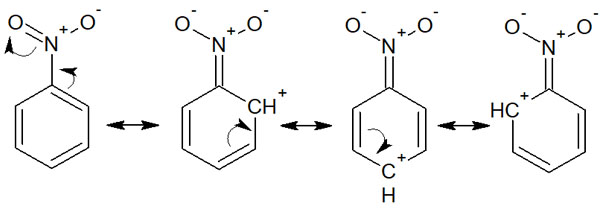
共鳴効果を考えると、メタ位とパラ位ではカチオン(プラス電荷をもつ炭素)を生じていることが分かります。電子の存在確率が低いため、この場所で求電子置換反応は起こりにくいです。その結果、電子が存在するメタの位置で置換反応が起こります。
中間体の安定性で説明されることもある
なお電子吸引基による配向性では、中間体の安定性にて説明されるケースも多いです。例えばニトロベンゼンで合成反応が起こるとき、中間体はそれぞれ以下のようになります。
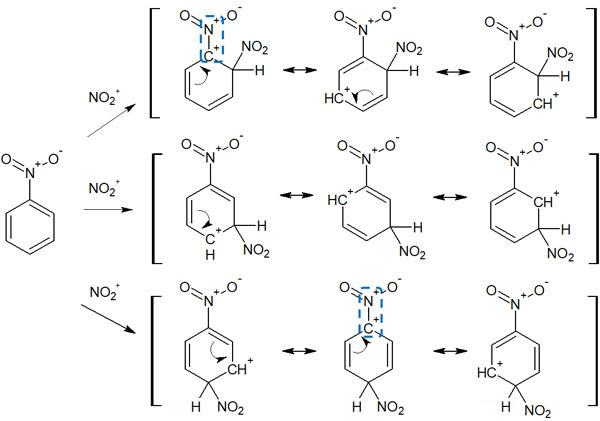
オルトまたはパラにて置換反応が起こる場合、上の図に記した通り、中間体の共鳴では「プラスの電荷が隣り合って存在している様子」を書くことができます。同じ電荷が隣り合うと反発します。これらの共鳴構造は不安定であり、共鳴による安定化には寄与しないことが分かります。
一方で、メタの位置で求電子置換反応が起こるときはどうでしょうか。プラスの電荷が隣り合う共鳴はなく、中間体は不安定ではありません。その結果、メタ配向性になります。
電子吸引基によるメタ配向性を説明するとき、この方法を利用する教授もいます。ただ理解するのが難しくなります。オルト・メタ・パラとすべての共鳴構造を書かなければ、中間生成物の安定構造が分かりません。そのため、共鳴効果(R効果)でメタ配向性を理解する方法が最も簡単です。
ハロゲン(塩素や臭素)はオルト・パラ配向性
それでは、ハロゲンの場合はどのようになるのでしょうか。芳香族化合物には、ハロゲンを有するケースも非常に多いです。有機化学で重要なハロゲンは以下になります。
- フッ素(F)
- 塩素(Cl)
- ブロモ(Br)
- ヨウ素(I)
これらハロゲンはオルト・パラ配向性になります。ハロゲンには非共有電子対(孤立電子)が存在し、これによって共鳴します。例えばクロロベンゼンでは以下のように共鳴します。
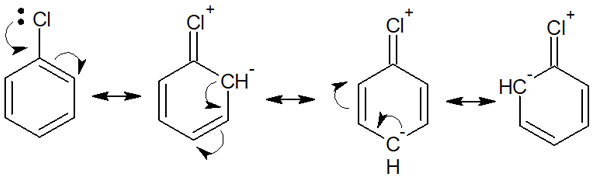
そのため電子供与基の事例で解説したのと同じように、クロロベンゼンはオルト・パラ配向性です。フッ素や塩素、ブロモ、ヨウ素を含め、ハロゲン置換基はオルト・パラ配向性と理解すればいいです。
誘起効果(I効果)により、反応性は下がる
しかし、一般的な電子供与基とハロゲンは性質が大きく異なります。ハロゲンは電気陰性度が非常に強いことが知られているため、ベンゼン環上の電子密度は低くなります。これは、ハロゲンによって電子が引き寄せられるからです。これを誘起効果(I効果)といいます。
共鳴によって電子が与えられ、ベンゼン環上の電子密度が高くなるのが電子供与基です。一方でハロゲンでは、電子を吸引します。
電子を与えながら、電子を引き寄せるというと、何だか意味が分かりません。ただ、ハロゲンでは2つのまったく異なる影響が存在しているため、このようになっています。
前述の通り、共鳴効果を考えるためハロゲン置換基はオルト・パラ配向性になります。通常、共鳴による効果は電気陰性度よりも強力です。そのため、ヒドロキシ基(-OH)やメトキシ基(-OCH3)、アミノ基(-NH2)は電子供与基であり、ベンゼン環の電子密度は高くなります。
しかし、ハロゲンは電気陰性度が強いことで知られています。電気陰性度により、電子を強く引き寄せる現象が誘起効果です。ハロゲンでは誘起効果が強くなるため、結果としてベンゼン環上の電子密度が低くなり、反応性が弱くなります。
- 共鳴効果:芳香環の電子密度を高くする(オルト・パラ配向性)
- 誘起効果:芳香環の電子密度を低くする
ハロゲンではまったく異なる2つの働きがあります。その結果、オルト・パラ配向性ではあるものの、ベンゼン環上の電子を吸引することで求電子置換反応の反応性が低くなっています。
アルキルベンゼン(トルエン)はオルト・パラ配向性
ここまで、さまざまな置換の配向性を確認してきました。ただ置換基にはアルキル鎖もあります。アルキル鎖が芳香環に存在する場合、配向性はどのようになるのでしょうか。
アルキルベンゼンでは、オルト・パラ配向性になります。アルキル鎖は電子を与えることで知られています。つまり電子供与基といえます。酸素原子や窒素原子のように非共有電子対(孤立電子)を有するわけではなく、積極的に共鳴するわけではないですが、炭素原子は電子を押し出す電子供与基として知られています。
電子供与性のある置換基は、どれもオルト・パラ配向性を示すと理解しましょう。
第3級カルボカチオンは安定しやすい
それでは、なぜアルキルベンゼンはオルト・パラ配向性を示すようになるのでしょうか。炭素原子は電子を与える働きがあるとはいっても、酸素原子や窒素原子のように共鳴するわけではありません。そのため、共鳴効果による説明とは異なる方法により、オルト・パラ配向性を説明する必要があります。
これには、カルボカチオンの安定性が関係しています。カルボカチオンは不安定な物質であるものの、構造によって安定性が変わります。カルボカチオンの中でも、「炭素原子が多く結合しているカルボカチオン」であるほど安定性が高いです。
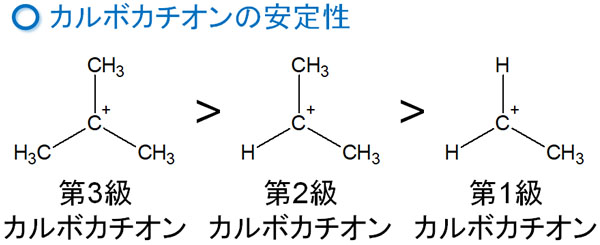
この性質の違いがアルキルベンゼンでの配向性の違いを生み出しています。
ここでは、例としてトルエンを考えてみます。ベンゼン環にメチル基が結合することで、トルエンになります。トルエンにて芳香族求電子置換反応が起こると、中間体の共鳴は以下のようになります。
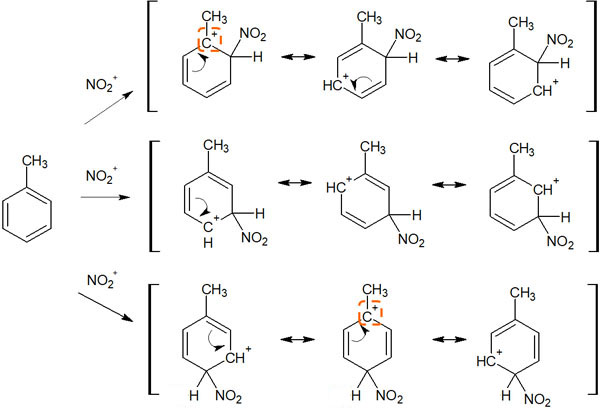
これら中間体の共鳴構造の中で、カルボカチオンの状態に着目しましょう。オルトとパラの位置に置換基があるときだけ、第三級カルボカチオンの共鳴構造を書くことができます。その結果、メタで置換反応が起こるよりも安定します。
前述の通り、カルボカチオンの中でも第三級カルボカチオンは、より安定な構造です。これがトルエンなどのアルキルベンゼンでオルト・パラ配向性を示す理由です。なお覚えるのが大変であれば、「アルキル鎖は電子供与性なのでオルト・パラ配向性を示す」と理解しても問題ありません。
電子供与基・電子吸引基で反応性が大きく変わる
このように、電子供与基なのか電子吸引基なのかによって配向性が大きく変わることを説明してきました。電子供与基ではオルト・パラ配向性となり、電子吸引基ではメタ配向性になります。
さらに、電子状態は芳香環化合物の反応性にも大きく影響します。以下のようになります。
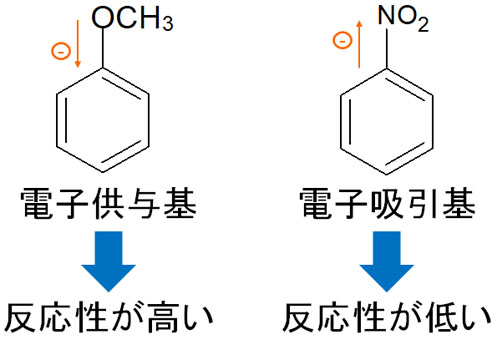
- 電子供与基:反応性が高くなる
- 電子吸引基:反応性が低くなる
ベンゼン環には多くの電子が存在しています。そのために求電子置換反応が起こります。ただ求電子置換反応という言葉から分かる通り、ベンゼン環上に多くの電子がなければ合成反応は起こりにくいです。
電子供与基が存在すれば、積極的に電子がベンゼン環の中に押し出されます。そのため電子供与基がベンゼン環にあると、少しのエネルギーを与えるだけで合成反応が起こるようになります。
一方で電子吸引基があると、反対に反応性が悪くなります。ベンゼン環に存在する電子が官能基に引き寄せられるため、ベンゼン環は電子が豊富な状態ではなくなります。電子吸引基が存在する場合、合成反応に必要な活性化エネルギーが大きくなります。
ベンゼン環の電子状態がどうなっているのかによって、求電子置換反応の様子が変わると考えましょう。
配向性と反応性(反応速度)のまとめ
それでは、ここまでの内容をまとめるとどのようになるでしょうか。ポイントとしては、以下のようになります。
- 電子供与基と電子吸引性で配向性が変わる
- ベンゼン環の電子が多いか少ないかで反応性(反応速度)が変わる
- ハロゲンはオルト・パラ配向性だが電子を吸引する
芳香族求電子置換反応では、以下のようになります。
| 置換基 | 位置 | 反応性 |
| -NH2、-NHR、-NR2 | オルト・パラ | とても速い |
| -OH | オルト・パラ | とても速い |
| -OR(R=CH3など) | オルト・パラ | とても速い |
| -R(アルキル鎖) | オルト・パラ | 速い |
| -H | – | 普通 |
| -F、-Cl、-Br、-I(ハロゲン) | オルト・パラ | 遅い |
| -COR(R=OH、OR、NH2など) | メタ | 遅い |
| -CN | メタ | 遅い |
| -SO3H | メタ | 遅い |
| -NO2 | メタ | 遅い |
なぜ、このような配向性になるのでしょうか。また、なぜこのように反応性(反応速度)が違ってくるのでしょうか。これは、すべて電子供与基と電子吸引基で説明することができます。
ハロゲンについては特殊であり、例外的にオルト・パラ配向性で反応性が悪くなります。これは電気陰性度が高く、誘起効果を引き起こしているからです。
置換基から配向性を推測する
置換基を見れば、電子供与基なのか電子吸引基なのかを見極められるようになり、配向性が分かります。例えば、アセトアニリドは電子供与基の置換基があります。
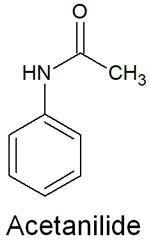
アセトアニリドにある窒素原子では、非共有電子対がベンゼン環へ電子を押し出します。その結果、電子供与性として機能することでオルト・パラ配向性になります。また、反応性は高くなります。置換基の性質により、芳香族化合物の配向性と反応性を予測できます。
なおアセトアニリドの場合、-NH-CO-CH3という置換基が存在します。それなりに大きな置換基なので、立体障害は大きくなります。そのためオルトよりも、パラの位置で求電子置換反応を起こす可能性が高くなります。
芳香族求電子置換反応を理解する
ベンゼン環には非常に多くの電子が存在するため、求電子置換反応を起こします。これを芳香族求電子置換反応といいます。
ただベンゼン環が求電子置換反応を起こすときには、法則があります。好き勝手なように置換反応を起こすわけではありません。オルト・メタ・パラのうち、どこで置換反応が起こるのかは決まっています。この理由については、ここまで説明してきた通りです。
中にはハロゲンのように、少し特殊な例があります。またオルト・パラ配向性では、置換基による立体障害を考慮しなければいけません。これらを考慮することで、どのような化合物合成が可能になるのかが分かります。また、反応性や反応エネルギーも推測できます。
ベンゼン環での反応は有機化学で非常に重要です。これらの配向性や反応性を理解して、目的の化合物を得るように合成反応を考えましょう。






